Genetska serija primjera nemetala. Genetski odnos između klasa supstanci - hipermarket znanja
Postoji genetska veza između jednostavnih supstanci, oksida, baza, kiselina i soli, odnosno mogućnosti njihove međusobne tranzicije (transformacije).
Na primer, jednostavna supstanca - kalcijum kao rezultat interakcije sa kiseonikom pretvara se u oksid: 2Ca + O 2 = 2CaO.
Kalcijum oksid u interakciji sa vodom formira kalcijum hidroksid CaO + H 2 O = Ca (OH) 2, a drugi, u interakciji sa kiselinom, pretvara se u so: Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O.
Ove transformacije mogu biti predstavljene shemom:
Ca → CaO → Ca (OH) 2 → CaSO 4
Slična šema se može napisati za nemetalne, na primer, sumpor:
S → SO 3 → H 2 SO 4 → CaSO 4
Dakle, ista sol se dobija na različite načine.
Reverzni prelaz iz soli u druge klase neorganskih jedinjenja i jednostavnih supstanci je takođe moguć:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 Na + Na 2 SO 4
Cu (OH) 2 = CuO + H 2 O
CuO + H 2 = Cu + H 2 O (redukcija bakra)
Sličan odnos između klasa neorganskih jedinjenja, zasnovan na proizvodnji supstanci jedne klase od supstanci drugog, naziva se genetski.
Svojstva kompleksnih spojeva ogledaju se u genetskoj šemi glavnih klasa neorganskih jedinjenja (vidi sliku). On odražava faze razvoja neorganske materije duž dvije glavne linije, od tipičnih metala do tipičnih nemetala sa suprotnim svojstvima.
Metali čije hemijsko svojstvo atoma je sposobnost da doniraju elektrone, i ne-metale, čije je glavno hemijsko svojstvo sposobnost njihovih atoma da vezuju elektrone koji su međusobno suprotni u svojstvima. Sa komplikacijom sastava supstanci, ove suprotne tendencije nastavljaju se pojavljivati.
Tipični metali i prijelazni elementi u najnižem oksidacijskom stanju formiraju osnovne okside, dok tipični nemetali i prijelazni elementi u visokom oksidacijskom stanju formiraju suprotne kisele okside.
Jednostavne supstance
Amphoteric
Nemetali
Osnovni oksidi
Amphoteric
Acidic
Grounds
Amphoteric
hidroksidi
Genetička shema glavnih klasa neorganskih jedinjenja
Sa dodatnim komplikacijama sastava supstanci, formiraju se hidroksidi, bazni oksidi koji odgovaraju bazi, i kiseli oksidi koji odgovaraju kiselini. Baze suprotne osobinama i kiselina aktivno reaguju jedna s drugom, formirajući soli. Interakcija suprotnosti je pokretačka snaga reakcije. Stoga, osnovni i kiseli oksidi, baze i kiseline aktivno međusobno djeluju, a dva kisela oksida ili dva bazična oksida ne stupaju u interakciju, jer su njihova svojstva bliska.
Stoga se svojstva kompleksnog spoja određuju na osnovu svojstava njegovih sastavnih elemenata. Glavni zakoni promjene ovih svojstava sažeti su u sljedećim primjenama (Tablica 6).
1. U periodima s povećanjem broja sekvenci, svojstva elemenata se mijenjaju od metalnog do nemetalnog. Povećava se broj elektrona na spoljnom nivou, povećava se stepen oksidacije elementa, smanjuje poluprečnik atoma i iona, povećava se energija jonizacije i afinitet za elektron. U skladu s tim, smanjuju se osnovna i kiselinska svojstva oksida i hidroksida.
2. U glavnim podgrupama, osnovna svojstva oksida i hidroksida se povećavaju sa povećanjem atomskog broja. Za elemente bočnih grupa sa povećanjem broja sekvenci, karakteristična je složenija promjena svojstava. Prvo, metalna svojstva su poboljšana, a zatim smanjena.
3. Aktivni metali odgovaraju oksidima i hidroksidima sa jako izraženim osnovnim svojstvima. Najaktivniji metali su alkalni i zemno-alkalni. Oni formiraju vodotopive okside i jake rastvorljive baze - alkalije.
4. Nisko aktivni metali (svi osim alkalnih i alkalnih) formiraju slabe baze koje se teško rastvaraju u vodi:
Cu (OH) 2, Fe (OH) 3.
5. Oksidi i hidroksidi sa izrazito izraženim kiselinskim svojstvima odgovaraju aktivnim nemetalima.
6. Amfoterni metali formiraju amfoterne okside i hidrokside.
7. Ako element ima različite stepene oksidacije, onda mu odgovaraju oksidi i hidroksidi različitih svojstava.
Tema: GENETIČKA POVEZANOST IZMEĐU metala i nemetala i njihovih jedinjenja. 9. razred
Ciljevi: edukativni: učvrstiti koncept "genetičke serije", "genetičke veze"; naučiti kako napraviti genetske nizove elemenata (metali i nemetali), da bi se napravile jednadžbe reakcije koje odgovaraju genetskoj seriji; provjerite kako se znanje uči kemijska svojstva oksidi, kiseline, soli, baze, razvoj: razviti sposobnost analize, poređenja, sumiranja i donošenja zaključaka, sastaviti jednadžbe kemijskih reakcija; edukativni: da promoviše formiranje naučnog svjetonazora.
Pružanje nastave: tabele "Periodni sistem", "Tabela rastvorljivosti", "Serija aktivnosti metala", uputstva za studente, zadaci za testiranje znanja.
Napredak: 1) Org. trenutak
2) Proverite d / s
3) Proučavanje novog materijala
4) Pričvršćivanje
5) D / C
1) Org. trenutak. Pozdrav
2) Proverite d / s.
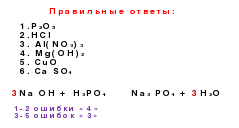
Genetske veze su veze između različitih klasa na osnovu njihovih interkonverzija.
Znajući klase neorganskih supstanci, moguće je napraviti genetske serije metala i nemetala. Osnova ovih serija je isti element.
Među metalima postoje dvije vrste redova:
1
. Genetska serija u kojoj alkali deluju kao baza. Ova serija može biti predstavljena korištenjem sljedećih transformacija:metal → osnovni oksid → alkalni → sol
Na primjer, K → K
2 O → KOH → KCl2
. Genetska serija, gde je baza nerastvorna baza, zatim serija može biti predstavljena kao lanac transformacija:metal → osnovni oksid → sol → netopljiva baza →
→osnovni oksid → metal
Na primjer, Cu → CuO → CuCl
2 → Cu (OH) \\ t 2 → CuO → Cu
1
. Genetska serija nemetala, gde rastvorljiva kiselina deluje kao veza u seriji. Lanac transformacija može se predstaviti na sledeći način:nemetalni → kiseli oksidi → rastvorljive kiseline → soli
Na primjer, P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. Genetska serija nemetala, gde nerastvorna kiselina deluje kao veza u seriji:nemetalni → kiselinski oksid → sol → kiselina →
→kiseli oksid → nemetalni
Na primjer
Si→ Sio 2 → Na 2 Sio 3 → H 2 Sio 3 → Sio 2 → Si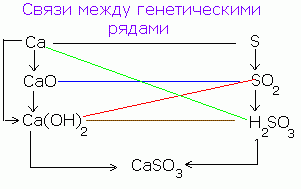
Frontalni razgovor o:
Šta je genetska veza? Genetske veze su veze između različitih klasa koje se zasnivaju na njihovim međusobnim konverzijama.
Genetička serija - serija supstanci - predstavnici različitih klasa, koji su jedinjenja jednog hemijskog elementa, povezani međusobnim konverzijama i reflektuju transformacije ovih supstanci. Osnova ovih serija je isti element.
Koje vrste genetskih serija se mogu razlikovati Među metalima se mogu razlikovati dva tipa serija:
a) Genetska serija u kojoj alkali djeluju kao baza. Ova serija može biti predstavljena korištenjem sljedećih transformacija:
metal → osnovni oksid → alkalni → sol
na primer, genetska serija kalijuma K → K
2 O → KOH → KClb) Genetska serija, gde je baza nerastvorna baza, onda se serija može predstaviti kao lanac transformacija:
metal → osnovni oksid → sol → nerastvorna baza → osnovni oksid → metal
na primjer: Cu → CuO → CuCl
2 → Cu (OH) \\ t 2 → CuO → CuOd nemetala moguće je razlikovati i dva tipa redova:
a) Genetska serija nemetala, gde rastvorljiva kiselina deluje kao veza u seriji. Lanac transformacija može se predstaviti na sledeći način: nemetalni → kiseli oksid → rastvorljive kiseline → soli.
Na primjer: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) Genetski red nemetala, gde nerastvorna kiselina: nemetalni → kiseli oksid → sol → kiselina → kiseli oksid → nemetalni deluje kao veza u seriji
Na primjer: Si → SiO
2 → Na 2 Sio 3 → H 2 Sio 3 → SiO 2 → SiIzvršavanje zadataka za opcije:
1. Izaberite formulu oksida u vašoj verziji, objasnite svoj izbor, na osnovu znanja o karakteristikama sastava ove klase jedinjenja. Zovi ih.
2. U koloni formule vaše varijante, pronađite formule kiseline i objasnite svoj izbor na osnovu analize sastava ovih jedinjenja.
3. Utvrditi valencije kiselinskih ostataka u kiselom sastavu.
4. Izaberite formule soli i navedite ih.
5. Napravite formule soli koje se mogu formirati magnezijumom i kiselinama iz vaše varijante. Zapišite ih.
6. U stupcu formule vaše varijacije, pronađite osnovne formule i objasnite svoj izbor na osnovu analize sastava ovih spojeva.
7. U vašoj varijanti izaberite formule supstanci sa kojima može reagovati rastvor ortofosforne kiseline (hlorovodonična, sumporna). Napravite odgovarajuće jednačine reakcije.
9. Među formulama vaše opcije, odaberite formule supstanci koje mogu međusobno djelovati. Napravite odgovarajuće jednačine reakcije.
10. Napravite lanac genetičkih veza neorganskih jedinjenja, koji će sadržati supstancu, čija je formula data u vašoj verziji pod brojem jedan.
Opcija 1
Opcija 2
Cao
Hno
3Fe (OH) \\ t
3N
2 OZn (NO
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbo
LiOH
Ag
3 PO 4P
2 O 5NaOH
Zno
CO
2BaCl
2HCl
H
2 CO 3H
2 SO 4Cuso
4Od ovih supstanci napravite genetsku liniju koristeći sve formule. Napišite reakcije jednačina pomoću kojih možete ostvariti ovaj lanac transformacija:
I opcija: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II opcija:Na 2 SO 4, NaOH, Na, Na 2 O 2 , Na 2 O4) Pričvršćivanje1.
Al→ Al 2 O 3 → AlCl 3 → Al( OH) 3 → Al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) \\ t 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) \\ t 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) \\ t 2 → FeS → FeSO 45) Domaći zadatak:
skicirati postepeni prelaz sa kalcijuma na kalcijum karbonat i pripremiti izvještaj o upotrebi bilo koje soli u medicini (koristeći dodatnu literaturu).

Među metalima se mogu razlikovati dvije vrste redova: 1. Genetička serija, u kojoj alkali djeluju kao baza. Ova serija se može predstaviti sljedećim transformacijama: metal - osnovni oksid - alkalna - sol, na primjer, genetska serija kalija K - K 2 O - KOH - KCl.

2. Genetska serija, u kojoj je osnovica nerastvorna baza, zatim serija može biti predstavljena kao lanac transformacija: metal - osnovni oksid - baza - nerastvorna sol - osnovni oksid - metal. Cu-- CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu genetska serija bakra "\u003e Cu je genetska serija bakra"\u003e "title =" (! LANG: 2. Genetska serija, gdje je baza nerastvorna baza, onda se serija može predstaviti kao lanac transformacija: metal - baza oksid - sol - netopljiva baza - glavni oksid je metal Cu-CuO-CuCl 2-Cu (OH) 2-CuO-\u003e"> title="2. Genetska serija, u kojoj je osnovica nerastvorna baza, zatim serija može biti predstavljena kao lanac transformacija: metal - osnovni oksid - baza - nerastvorna sol - osnovni oksid - metal. Cu-- CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e"> !}
Među nemetalima moguće je razlikovati i dvije vrste redova: 1. Genetska serija nemetala, gdje solubilna kiselina djeluje kao veza u seriji. Lanac transformacija može se predstaviti na sledeći način: ne-metal - kiselina oksid - rastvorljiva kiselina - -sol. P-- P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Fosforni genetički opseg

Postoji genetska veza između klasa neorganskih jedinjenja. Od jednostavnih supstanci možete dobiti kompleks i obrnuto. Od jedinjenja jedne klase možete dobiti jedinjenja druge klase.
Pojednostavljeni genetski odnos između klasa neorganskih jedinjenja može se predstaviti sljedećom shemom:
Redoslijed takvih transformacija za nemetale može se predstaviti sljedećom shemom: CANPO 4
R → R 2 O 5 → N 3 RO 4 → S 3 (RO 4) 2
(Saon) 3 PO 4
Za tipične metale možete napraviti sledeći lanac transformacija:
Ba → BaO → Ba (OH) 2 → BaSO 4
Za metale čiji su oksidi i hidroksidi amfoterni (polumetali), mogu se izvršiti sledeće transformacije:
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al (OH) 3 → Al 2 O 3.
Veze između klasa:
1. Metali, nemetali→ sol.
Direktnom interakcijom metala i nemetala nastaju soli kiselina bez kisika (halogenidi, sulfidi):
2Na + C1 2 = 2NaCl
Ova jedinjenja su stabilna i ne razlažu se prilikom zagrijavanja.
2. Osnovni oksidi, kiseli oksidi→ sol.
CaO + CO 2 = CaCO 3;
Na 2 O + SO 3 = Na 2 SO 4.
3. Baze, kiseline→ sol.
Provodi se reakcijom neutralizacije:
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O,
HE - + H + → H 2 O;
Mg (OH) 2 + 2HC1 = MgCl 2 + 2H 2 O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O.
4. Metali→ osnovne okside.
Većina metala u interakciji sa kiseonikom formira okside:
2Ca + O 2 = 2CaO;
4A1 + 3O 2 = 2A1 2 O 3.
Zlato, srebro, platina i drugi plemeniti metali nisu u interakciji sa kiseonikom, oksidi takvih metala se dobijaju indirektno.
5. Ne-metali→ kiseli oksidi.
Nemetali (sa izuzetkom halogena i plemenitih gasova) u interakciji sa kiseonikom, formirajući okside:
4P + 5O2 = 2P2O5;
S + O 2 = SO 2.
6. Osnovni oksidi→ osnova.
Direktnom interakcijom sa vodom mogu se dobiti samo hidroksidi alkalnih i zemnoalkalnih metala (alkali):
Na2O + H2O = 2NaOH;
CaO + H 2 O = Ca (OH) 2.
Ostatak se dobija indirektno.
7. Kiselinski oksidi→ kiselina.
Kiseli oksidi reaguju sa vodom da bi se formirale odgovarajuće kiseline:
SO3 + H2O = H2SO4;
R 2 O 5 + 3H 2 O = 2H 3 PO 4.
Izuzetak je SiO 2, koji ne reaguje sa vodom.
8. Baze, kiseli oksidi→ sol.
Alkali stupaju u interakciju sa kiselim oksidima da bi se formirale soli:
2NaOH + SO 3 = Na 2 SO 4 + H 2 O,
2OH - + SO3 = SO4 2- + H20;
Ca (OH) 2 + SO 2 = CaCO 3 Н + N 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 + H 2 O.
9. Kiseline, bazični oksidi→ sol.
Metalni oksidi rastvaraju se u kiselinama, formirajući soli:
CuO + H 2 SO 4 = CuSO 4 + H 2 O,
CuO + 2H + = Cu 2+ + H 2 O;
Na 2 O + 2HS1 = 2NaCl + H 2 O,
Na2O + 2H + = 2Na + + H 2 O.
10. Grounds→ osnovne okside.
Nerastvorljive baze i LiOH rastvaraju se prilikom zagrijavanja:
2LiOH = Li 2 O + H 2 O;
Cu (OH) 2 = CuO + H 2 O.
11. Kiseline→ kiseli oksidi.
Nestabilne kiseline koje sadrže kiseonik razlažu se prilikom zagrijavanja (H 2 SiO 3) pa čak i bez zagrijavanja (H 2 CO 3, HClO). Istovremeno, određeni broj kiselina je otporan na zagrijavanje (H 2 SO 4, H 3 PO 4).
H 2 SiO 3 = H 2 O + SiO 2;
H 2 CO 3 = H 2 O + CO 2.
12. Metalni oksidi→ metali.
Neki oksidi teških metala mogu se razgraditi na metal i kiseonik:
2HgO = 2Hg + O 2.
Takođe, metali se dobijaju iz odgovarajućih oksida uz pomoć redukcionih sredstava:
3MnO2 + 4Al = 3Mn + 2Al2O3;
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O.
13. Kiselinski oksidi→ nemetali
Većina ne-metalnih oksida se ne raspada pri zagrevanju. Nemetalni i kiseonik razlažu samo neke nestabilne okside (halogene okside).
Neki nemetali se dobijaju redukcijom iz odgovarajućih oksida:
SiO 2 + 2Mg = 2MgO + Si.
14. Soli, baze → baze.
Nerastvorljive baze se dobijaju djelovanjem alkalija na otopine odgovarajućih kiselina:
CuSO 4 + 2NaOH = Cu (OH) 2 Na + Na 2 SO 4,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl 2 + 2KOH = Fe (OH) 2 2 + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2 ↓.
15. Soli, kiseline → kiseline.
Solubilne soli reaguju sa kiselinama (u skladu sa serijom pritiska) ako je rezultat slabija ili isparljiva kiselina:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (s) + H 2 SO 4 (k) = NaHS04 + HCl.
16. Soli→ osnovne okside, kisele okside.
Soli nekih kiselina koje sadrže kiseonik (nitrati, karbonati) razgrađuju se pri zagrijavanju:
CaCO 3 = CaO + CO 2;
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2.
VJEŽBE ZA NEZAVISNI RAD NA TEMI “GENETIČKA POVEZANOST KLASA NEORGANSKIH SPOJEVA”
1. Navedite dolje navedene tvari, rasporedite ih u klase neorganskih spojeva: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, Ba 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O 7, Fe (OH) 2, P 2 O 5, HF, MnO 2.
2. Od kojih supstanci koje su navedene u nastavku moguće je dobiti hidroksid (kiselina ili baza) u jednoj fazi: bakar, željezni oksid (P), barijev oksid, dušikov oksid (P), dušikov oksid (V), oksid silicija, bakar sulfat, kalijev klorid , kalij, magnezijum karbonat.
3. Iz gornje liste napišite formule tvari koje se odnose na: 1) okside; 2) osnove; 3) kiseline; 4) soli:
CO 2, NaOH, HCl, SO3, CuSO4, NaNO3, KCl, H2S04, Ca (OH) 2, P 2 O 5, HNO 3, Al (OH) 3.
4. Navedite supstance: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4) ) 2, CO, HI. Navedite kojoj klasi pripada svaka supstanca.
5. Napišite molekularne formule sledećih supstanci i navedite u kojoj klasi svaka supstanca pripada:
1) bakar (II) hidroksoksarbonat;
2) azotni oksid (V);
3) nikl (II) hidroksid;
4) barijum hidrogen fosfat;
5) perklorna kiselina;
6) hrom (III) hidroksid;
7) kalijum hlorat;
8) hidrogen sulfidna kiselina;
9) natrijum cinkat.
6. Navedite primjere reakcija na vezu između:
1) jednostavne supstance - nemetali;
2) jednostavna supstanca i oksid;
3) oksidi;
4) složene supstance koje nisu oksidi;
5) metalni i nemetalni;
6) tri supstance.
7. Koja od sledećih supstanci može reagovati:
1) ugljen monoksid (IV): HCl, O2, NO2, KOH, H20;
2) magnezijum oksid: Ba (OH) 2, HCl, CO 2, O 2, HNO 3;
3) gvožđe (II) hidroksid: KCl, HCl, KOH, O 2, H 2 O, HNO 3;
4) klorovodik: Zn, MgO, ZnCl2, HNO3, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Da li je moguća interakcija između sledećih supstanci?
1) ugljen monoksid (IV) i kalijum hidroksid;
2) kalijum hidrosulfat i kalcijum hidroksid;
3) kalcijum fosfat i sumporna kiselina;
4) kalcijum-hidroksid i sumpor-oksid (IV);
5) sumporna kiselina i kalijum hidroksid;
6) kalcijum bikarbonat i fosforna kiselina;
7) silicijum dioksid i sumporna kiselina;
8) cink oksid i fosfor oksid (V).
Napišite jednadžbe mogućih reakcija, odredite uslove u kojima se pojavljuju. Ako reakcije mogu dovesti do različitih supstanci, onda naznačite koja je razlika u uslovima njihove primjene.
9. Dati jednadžbe reakcija za dobivanje sljedećih tvari: natrijev ortofosfat (4 načina), kalijev sulfat (7 načina), cinkov hidroksid.
10. Jedna od metoda za proizvodnju sode (natrijum karbonata) je djelovanje vode i ugljičnog monoksida (IV) na natrijev aluminat. Sastavite jednačine reakcije.
11. On mijenja koeficijente, piše proizvode reakcije:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Al (OH) 3 →
4) P 2 O 5 + 4 NaOH →
5) P 2 O 5 + 6 NaOH →
6) P 2 O 5 + 2 NaOH →
12. Napraviti jednadžbe reakcija za primanje različitih vrsta soli:
1) SO 2 + Ba (OH) 2 → (srednje i kisele soli),
2) A1 2 O 3 + H 2 O + HNO 3 → (srednja sol, bazne soli),
3) Na 2 O + H 2 S → (srednje i kisele soli),
4) SO 3 + Sa (OH) 2 → (srednje i bazne soli),
5) CaO + H 2 O + P 2 O 5 → (bazna sol, kisele soli).
13. Dovršite jednadžbe reakcije:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (nedovoljno) →
AlCl 3 + NaOH (deficijentan) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (višak) →
AlC1 3 + NaOH (višak.) → Ca (AlO 2) 2 + HCl (višak) →
14. Zapišite jednadžbe reakcija kojima možete izvršiti sljedeće transformacije:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) R → R 2 O 5 → N 3 RO 4 → K 3 RO 4 → S 3 (RO 4) 2 → N 3 RO 4
4) Mg → MgO → MgCl 2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca (OH) 2 → CaCO 3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaSrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca (NO 3) 2
15) CuO → CuCl 2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl 3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl 2 → Ca → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl 2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl 2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) aluminijum sulfat → aluminijum hlorid → aluminijum nitrat → aluminijum oksid → kalijum aluminat → aluminijum hidroksid → aluminijum hidroksid → aluminijum hlorid.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) barijum → barijum hidroksid → barijev bikarbonat → barijum hlorid → barijum karbonat → barijum hlorid → barijum hidroksid
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) S → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) R 2 O 5 → N 3 RO 4 → SONRO 4 → S (N 2 RO 4) 2 → S 3 (RO 4) 2
55) Fe → FeCl 2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHC03 → Na2C03 → NaCl → NaHS04 → Na2S04
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na2S04 → NaCl
64) Al → AlCl 3 → Al (OH) 3 → A1 2 O 3 → Al (OH) 3
65) CuO → Cu → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl 2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO 3 → MgO → MgCl 2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgSO 4 → MgCO 3 → Mg (HCO 3) 2
72) CaO → Ca (OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca (HCO 3) 2 → CaCl 2 → Ca (NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl 2 → CaCO 3 → Ca (HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca (NO 3) 2
84) Na 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) S → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
88) HCl → CuCl2 → Cl2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH 3 → NH 4 C1 → NH 3 H 2 O → NH 4 HCO 3 → NH 3
91) NH 4 C1 → KC1 → HCl → CuCl 2 → Cu (OH) 2
92) NH 3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHC03 → Na2S04 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1 (NO 3) 3 → A1 2 O 3 → Al (OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca (OH) 2 → CaCl 2 → Ca (NO 3) 2
112) NaOH → Na2C03 → NaHS04 → NaNO3 → NaHS04
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO 3) 2 → CaO → CaCl 2
125) NH 3 2 H 2 O → NH 4 C1 → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO 3) 2 → CaCl 2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 2 H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl 3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al (OH) 3 → Na 3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na 2 → Be (OH) 2 → Na 2 BeO 2 → BaBeO 2
EKSPERIMENTALNA ISKUSTVA NA TEMI “OSNOVNE KLASE ANORGANSKIH SPOJEVA”
ISKUSTVO 1.Reakcije neutralizacije.
a) Interakcija jake kiseline i jake baze.
Ulijte 5 ml 2N rastvora hlorovodonične kiseline u porcelansku posudu i dodajte u rastvor 2 n natrijum hidroksida. Mešajte rastvor sa staklenom šipkom i testirajte njegov efekat na lakmus, prenoseći kap otopine u lakmus test. Neophodno je postići neutralnu reakciju (plavi i crveni lakmus papir ne mijenja boju). Isparite dobijeni rastvor do suvog. Šta je formirano? Zapišite jednadžbe molekularne i ionske reakcije.
b) Interakcija slabe kiseline i jake baze.
Sipajte u epruvetu 2 ml 2N alkalne otopine i dodajte otopinu octene kiseline dok otopina nije neutralna. Zapišite jednadžbe molekularne i ionske reakcije. Objasnite zašto se ravnotežna ionska reakcija, u kojoj sudjeluje slab elektrolit (octena kiselina), pomiče prema formiranju molekula vode.
ISKUSTVO 2. Amfoterni hidroksidi.
Od raspoloživih reagensa u laboratoriji, dobiti talog cinkovog hidroksida. Dobijeni talog protresti i ulijte male količine u 2 epruvete. U jednu od epruveta dodati rastvor solne kiseline, u drugom - rastvor natrijum hidroksida (višak). Šta se posmatra? Zapišite jednadžbe odgovarajućih reakcija u molekularnom i ionskom obliku.
ISKUSTVO 3.Hemijska svojstva soli.
a) Interakcija rastvora soli sa formiranjem slabo rastvorljive supstance.
Ulijte 2 ml rastvora natrijum karbonata u epruvetu i dodajte rastvor barijum hlorida dok se ne pojavi beli talog. Napišite jednadžbu kemijske reakcije u ionskom i molekularnom obliku. Talog je podijeljen na dva dijela. Sipajte otopinu sumporne kiseline u jednu od epruveta i natrijum hidroksid u drugu. Napravite zaključak o topljivosti taloga u kiselinama i alkalijama.
b) Interakcija rastvora soli sa kiselinama da bi se dobilo isparljivo jedinjenje.
Ulijte 2 ml rastvora natrijum karbonata u epruvetu i dodajte malu količinu rastvora hlorovodonične kiseline. Šta se posmatra? Napišite jednadžbe kemijske reakcije u ionskom i molekularnom obliku.
c) Interakcija rastvora soli sa alkalijama sa formiranjem isparljivog jedinjenja.
Ulijte malo rastvora amonijumove soli u epruvetu, dodajte 1-2 ml rastvora natrijum hidroksida i zagrejte do ključanja. U epruvetu s reakcijskom smjesom napravite mokri crveni lakmus test. Šta se posmatra? Dajte objašnjenje. Napišite jednadžbe reakcije.
g ) Interakcije soli sa aktivnijim metalima od metala koji je deo soli.
Očistite željezni (čelični) ekser finim brusnim papirom. Zatim umočite u rastvor bakar sulfata. Posle izvesnog vremena, posmatrajte oslobađanje bakra na površini nokta. Napišite odgovarajuću reakcijsku jednadžbu u ionskom i molekularnom obliku.
ISKUSTVO 4.Dobijanje osnovnih i kiselih soli.
a) Priprema olovnog hidroksoksarbonata.
Dodati malo olova (II) oksida u rastvor olova (II) acetata i mešati nekoliko minuta. Ohlađeni rastvor se odvodi iz taloga i kroz njega prolazi struja ugljičnog dioksida. Šta se posmatra? Precipitat se filtrira i suši između listova filter papira. Označite boju i prirodu nastalog precipitata olovnog hidroksoksarbonata. Napišite jednadžbe reakcije. Napravite grafičku formulu dobivene soli.
b) Priprema magnezijum bikarbonata.
Veoma razređenom rastvoru neke magnezijumove soli dodajte malo rastvora natrijum karbonata. Koja supstanca se taloži? Zasićeni rastvor sa precipitatom sa ugljen-dioksidom. Obratite pažnju na postepeno otapanje taloga. Zašto se to događa? Napišite jednadžbe reakcije.
ISKUSTVO 5.Dobijanje kompleksnih soli.
a) Formiranje jedinjenja sa kompleksnim kationom.
Dodajte rastvor amonijaka kap po kap u epruvetu sa 2-3 ml rastvora bakar (II) hlorida dok se ne formira talog bakar (II) hidroksida, a zatim dodajte višak rastvora amonijaka da bi se rastvorio talog. Uporedite boju iona Cu 2+ sa bojom dobijenog rastvora. Koji ioni su prisutni u otopini? Napišite reakcijsku jednadžbu za dobivanje kompleksnog spoja.
b) Formiranje jedinjenja sa kompleksnim anionom.
U 1-2 ml rastvora živinog (II) nitrata kap po kap dodati razblaženi rastvor kalijum jodida kako bi nastao talog HgI 2. Zatim ulijte suvišak rastvora kalijum jodida dok se talog ne otopi. Napišite reakcije dobivanja kompleksne soli.
ISKUSTVO 6.Priprema dvostrukih soli (kalijum alum).
Izmeriti 7,5 g Al 2 (SO 4) 3 H 18H 2 O i rastvoriti u 50 ml vode, uzimajući dovoljno veliku porculansku posudu za tu svrhu. Izračunajte jednačinu reakcije i izmerite masu kalijum sulfata neophodnu za reakciju. Pripremite vrući zasićeni rastvor kalij sulfata i prelijte ga u porculansku posudu s otopinom aluminij sulfata uz miješanje. Posle određenog vremena pratiti taloženje kristala aluminijum-kalij-aluminijuma. Nakon hlađenja i kristalizacije, izlijte matičnicu, osušite alum kristale između listova filter papira i izvadite nastale kristale. Izračunajte procenat prinosa.
ZADACI ZA NASELJE
1. Propuštanjem viška vodonik sulfida kroz 16 g rastvora bakar (II) sulfata dobijeno je 1.92 g taloga. Nađite maseni udio bakar sulfata u upotrebljenom rastvoru i količinu potrošenog sumporovodika.
2. Za potpuno taloženje bakra u obliku sulfida iz 291 cm3 rastvora bakar (II) sulfata sa masenim udjelom od 10% upotrijebljen je plin dobiven reakcijom 17,6 g željezovog (II) sulfida sa suviškom klorovodične kiseline. Nađite gustinu originalnog rastvora bakar sulfata.
3. Gas koji se oslobađa tokom interakcije K 2 S otopine s razrijeđenom sumpornom kiselinom prolazi kroz višak otopine olova (II) nitrata. Nastali talog ima masu od 71,7 g. Nađite zapreminu reagovanog rastvora sumporne kiseline, ako je njegova gustina 1,176 g / cm3, a maseni udio je 25%.
4. U rastvor koji sadrži 8 g bakar (II) sulfata, doda se rastvor koji sadrži 4,68 g natrijum sulfida. Talog je filtriran, filtrat je isparen. Utvrdite masu supstanci u filtratu nakon isparavanja i masu taloga bakar sulfida.
5. Neki od sulfida gvožđa (II) su tretirani sa viškom hlorovodonične kiseline. Dobijeni gas u reakciji sa 12,5 cm3 rastvora NaOH sa masenim udjelom od 25% i gustoćom od 1,28 g / cm 3 formira kiselinsku sol. Nađite masu prvobitnog sulfida željeza.
6. Željezo (II) sulfid težine 176 g je tretiran sa viškom hlorovodonične kiseline, a nastali gas je spaljen u višku vazduha. Kolika je zapremina otopine KOH sa masenim udjelom od 40% i gustoćom od 1,4 g / cm3 da bi se potpuno neutralizirao plin proizveden tijekom izgaranja?
7. Prilikom prženja 100 g tehničkog pirita, dobili su gas, koji je potpuno neutralizovan sa 400 cm3 rastvora NaOH sa masenim udjelom od 25% i gustoćom od 1.28 g / cm3. Odrediti maseni udio nečistoća u piritu.
8. U 2 g mješavine željeza, željeznog oksida (II) i željeznog oksida (III) dodano je 16 cm3 otopine HC1 s masenim udjelom od 20% i gustoćom od 1,09 g / cm3. Za neutralizaciju suviška kiseline, potrebno je 10.8 cm3 otopine NaOH s masenim udjelom od 10% gustoće od 1,05 g / cm3. Nađite mase tvari u smjesi ako je volumen oslobođenog vodika 224 cm 3 (NU).
9. Postoji smjesa Ca (OH) 2, CaCO 3 i BaSO 4 mase 10,5 g. Kada je smjesa obrađena sa suviškom klorovodične kiseline, oslobođeno je 672 cm 3 (IU) plina, a 71,2 g kiseline reagiralo je s masom. udio od 10%. Odredite masu supstanci u smeši.
10. Postoji mešavina barijum hlorida, kalcijum karbonata i natrijum bikarbonata. Kada se 10 g ove smeše rastvori u vodi, nerastvorni ostatak je jednak 3,5 g. Prilikom kalcinacije 20 g početne smeše, masa se smanjuje za 5,2 g.
11. Postoji rastvor koji sadrži i sumpornu i azotnu kiselinu. Da bi se potpuno neutralizovalo 10 g ovog rastvora, konzumira se 12,5 cm3 rastvora KOH sa masenim udjelom od 19% i gustinom od 1,18 g / cm3. Kada se višak barijum klorida doda u 20 g iste smeše kiselog rastvora, ispada 4,66 g taloga. Nađite masene frakcije kiselina u smjesi.
12. Svi vodonik-hloridi dobiveni iz 100 g smjese KC1 i KNO3 otopljeni su u 71,8 cm3 vode. Pri kalcinaciji 100 g iste smjese soli ostaje 93,6 g krutog ostatka. Pronađite maseni udio klorovodika u vodi.
13. Prolaskom 2 m 3 vazduha (NU) kroz rastvor Ca (OH) 2, dobijeno je 3 g taloga soli ugljene kiseline. Nađite zapreminu i maseni udio CO 2 u zraku.
14. Ugljen-dioksid prolazi kroz suspenziju koja sadrži 50 g CaCO3. Reakcija je iznosila 8,96 dm 3 gasa (NU). Kolika je masa CaCO 3 u čvrstoj fazi?
15. Kada se dodaje voda u CaO, njegova masa se povećava za 30%. Koji dio CaO (u masenim%) je ugašen?
16. Olovni (II) oksid težine 18,47 g zagrevan je u vodonosnoj struji. Nakon reakcije masa nastalog olova i nereagiranog oksida iznosila je 18,07 g. Kolika je masa olovnog oksida koja nije reagirala?
17. Ugljen monoksid prolazi kroz željezni (III) oksid kada se zagrijava. Masa čvrstog ostatka nakon reakcije je 2 g manja od početne mase oksida gvožđa. Kolika je količina CO uzimala reakcija (je li oksid potpuno smanjen)?
18. Postoji 8,96 dm 3 (NU) mješavine N2, CO2 i SO2 sa relativnom gustoćom vodika 25. Nakon prolaska kroz višak otopine KOH, volumen smjese se smanjio za 4 puta. Pronađite količine gasova u originalnoj smeši.
19. U dvije čaše nalazi se 100 g HC1 otopine s masenim udjelom od 2,5%. U jednu čašu dodano je 10 g CaCO 3, u drugom - 8,4 g MgCO 3. Kako će se masa naočara razlikovati nakon reakcije?
20. Koja zapremina (NU) sumpor dioksida mora biti propuštena kroz 200 cm3 rastvora sa 0,1% masenog udjela NaOH i gustine od 1 g / cm3 da bi se dobila kiselinska sol?
21. Kolika je maksimalna količina (ugljendioksid) ugljičnog dioksida može apsorbirati 25 cm3 otopine sa 25% masenog udjela NaOH i gustoće od 1,1 g / cm3?
22. Kolika je minimalna zapremina otopine sa masenim udjelom od 20% KOH i gustoćom od 1,19 g / cm3 koja može apsorbirati sav proizvedeni ugljični dioksid uz punu redukciju 23,2 g magnetita s ugljičnim monoksidom?
23. Koja je minimalna masa KOH koja mora reagirati sa 24,5 g ortofosforne kiseline tako da je proizvod samo kalijev dihidrogen fosfat?
24. Kolika je minimalna masa Ca (OH) 2 za dodavanje 16 g rastvora kalcijum bikarbonata sa masenim udjelom od 5% soli da bi se dobila srednja sol?
25. Koju masu kalijum hidrogen fosfata treba dodati u otopinu koja sadrži 12,25 g H3P04 tako da nakon toga otopina sadrži samo kalijev dihidrogen fosfat?
26. Rastvor je sadržao 56,1 g mešavine karbonata kalcijuma i magnezijuma u suspenziji. Da bi ih pretvorili u hidrokarbonate, potrošili su sav ugljen dioksid proizveden sagorevanjem 7 dm 3 (NU) etana. Nađite masu kalcijum karbonata u početnoj smjesi.
27. Za pretvaranje 9,5 g smeše natrijum-hidrohidroksida i dihidrogenfosfata u srednju so, neophodno je 10 cm3 rastvora sa masenim udjelom NaOH 27,7% i gustinom 1,3 g / cm3. Nađite masu hidrogen fosfata u smjesi.
28. Prenošenjem ugljen-dioksida kroz rastvor koji sadrži 6 g NaOH, dobijeno je 9,5 g smeše kiselih i srednjih soli. Nađite količinu potrošenog ugljičnog dioksida.
29. Nakon prolaska 11,2 dm 3 (NU) CO 2 kroz otopinu KOH, dobiveno je 57,6 g smjese kiselih i srednjih soli. Pronađite masu srednje soli.
30. Koja masa ortofosforne kiseline mora biti neutralizirana da bi se dobilo 1,2 g dihidro- i 4,26 g natrijum hidrogen fosfata?
31. NaOH je dodan u otopinu sumporne kiseline da bi se dobilo 3.6 g hidrosulfata i 2.84 g natrijum sulfata. Odredite hemijske količine kiseline i lužine koje su reagovale.
32. Posle propuštanja hlorovodonika kroz 200 cm3 rastvora NaOH sa masenim udjelom od 10% i gustoćom od 1,1 g / cm3, maseni udio NaOH u nastalom rastvoru se smanjio za pola. Odredite maseni udio NaCl u dobijenom rastvoru.
33. Rastvaranje 14,4 g mešavine bakra i njegovog oksida (II) potrošilo je 48,5 g rastvora sa HNO 3 masenim udjelom od 80%. Nađite masene frakcije bakra i oksida u početnoj smjesi.
34. Masa natrijum-oksida od 6,2 g je rastvorena u 100 cm3 vode i dobiven je rastvor 1. Tada je u otopinu dodana klorovodična kiselina sa masenim udjelom od 10% sve dok medijum nije postao neutralan i dobiven je otopina br. : \\ T
1) maseni udjeli tvari u otopinama br. 1, 2;
2) masa otopine HC1, koja je neutralizirala otopinu broj 1.
35. 3 g cinka u interakciji sa 18.69 cm3 rastvora HC1 sa masenim udjelom od 14.6% i gustoćom od 1.07 g / cm3. Kada se zagreje, dobijeni gas se prenosi preko vrelog CuO mase 4 g. Koja je masa dobijenog bakra?
36. Gas koji se oslobađa nakon tretmana kalcijum hidrida sa viškom vode, propušta preko FeO. Kao rezultat, masa oksida se smanjila za 8 g. Nađite masu CaH 2 tretiranu vodom.
37. Tokom kalcinacije uzorka CaCO 3, njegova masa se smanjila za 35,2%. Čvrsti reakcijski produkti su otopljeni u suvišku klorovodične kiseline da bi se dobilo 0,112 dm3 (NU) plina. Odredite masu originalnog uzorka kalcijum karbonata.
38. Bakar nitrat se razgradio i rezultirajući bakar (II) oksid je potpuno redukovan vodonikom. Dobijeni proizvodi su prošli kroz cev sa P 2 O 5, a masa cevi nakon toga povećana za 3,6 g. Kolika je minimalna zapremina sumporne kiseline sa masenim učešćem od 88% i gustinom od 1,87 g / cm3 potrebnom za rastvaranje dobijeno u eksperimentu. bakar i kolika je masa razložene soli?
39. Nakon apsorpcije azotnog oksida (IV) suviškom otopine KOH na hladnom u odsustvu kisika, dobijeno je 40,4 g KNO3. Koja je materija još formirana i kakva je njena masa?
40. Za neutralizaciju 400 g rastvora koji sadrži hlorovodonično i sumporna kiselina, potrošeno je 287 cm3 rastvora natrijum hidroksida sa masenim udjelom od 10% i gustoćom od 1,115 g / cm3. Ako se u 100 g početnog rastvora doda višak rastvora barijum hlorida, ispada 5,825 g taloga. Odredite masene frakcije kiselina u početnom rastvoru.
41. Nakon prolaska ugljičnog dioksida kroz otopinu natrijevog hidroksida, dobiveno je 13,7 g smjese srednjih i kiselih soli. Za pretvaranje u natrijum-hlorid potrebno je 75 g hlorovodonične kiseline sa masenim udjelom HCl od 10%. Nađite količinu apsorbovanog ugljičnog dioksida.
42. Mešavina hlorovodonične i sumporne kiseline sa ukupnom masom od 600 g rastvora sa istim masenim frakcijama kiselina tretirana je suviškom natrijum bikarbonata i dobijeno je 32.1 dm3 gasa (Br.). Nađite maseni udio kiselina u početnoj smjesi.
43. Za neutralizaciju 1 dm 3 otopine NaOH, potrošeno je 66.66 cm3 otopine HNO3 s masenim udjelom od 63% i gustoćom od 1.5 g / cm3. Koja količina otopine sumporne kiseline sa masenim udjelom od 24,5% i gustoćom od 1,2 g / cm3 bi bila potrebna za neutralizaciju iste količine alkalija?
44. U kom volumnom omjeru treba uzeti otopinu sumporne kiseline s masenim udjelom od 5% i gustoćom od 1,03 g / cm3 i otopinom barijevog hidroksida s masenim udjelom od 5% i gustoćom od 1,1 g / cm3 za potpunu neutralizaciju? Zamislite odgovor kao količnik zapremine alkalne otopine na kiselom rastvoru.
45. Izračunajte minimalnu zapreminu rastvora amonijaka sa gustinom od 0,9 g / cm3 i masenim udjelom od 25%, koji je neophodan za potpunu apsorpciju ugljičnog dioksida dobivenog razgradnjom 0,5 kg prirodnog vapnenca s masenim udjelom kalcijevog karbonata od 92%.
46. Za potpunu konverziju 2.92 g smjese natrijevog hidroksida i natrijevog karbonata u klorid, potrebno je 1.344 dm3 klorovodika (NU). Nađite masu natrijum karbonata u smjesi.
47. U 25 g rastvora bakar (II) sulfata sa masenim udjelom od 16% dodaje se količina otopine natrijum hidroksida sa udjelom mase 16%. Nastali talog je filtriran, nakon čega je filtrat bio alkalni. Da bi se filtrat potpuno neutralizirao, potrebno je 25 cm3 otopine sumporne kiseline s molarnom koncentracijom 0,1 mol / dm 3 otopine. Izračunajte masu dodanog rastvora natrijum hidroksida.
48. Supstanca dobijena potpunom redukcijom CuO sa masom od 15,8 g vodonika zapremine 11,2 dm3 (NU) otopljena je zagrijavanjem u koncentriranoj sumpornoj kiselini. Kolika je količina gasa (NU) koji se oslobađa kao rezultat reakcije?
49. Za potpunu neutralizaciju 50 cm3 hlorovodonične kiseline masenim udjelom HCl od 20% i gustoću od 1,10 g / cm3, korišten je rastvor kalijevog hidroksida masenog udjela KOH od 20%. Kolika je količina vode sadržane u otopini?
50. Gas dobiven propuštanjem suviška CO 2 preko 0,84 g vrućeg ugljena, šalje se u reakciju s 14,0 g zagrijanog bakar (II) oksida. Kolika je zapremina rastvora azotne kiseline sa masenim udjelom od 63% i gustoćom od 1,4 g / cm3 da bi se potpuno otopila supstanca dobijena u posljednjoj reakciji?
51. Kada je kalcinisana do konstantne težine bakar (II) nitrata, težina soli se smanjila za 6,5 g.
52. Kada je korišćen višak hlorovodonične kiseline, 6.72 dm3 (NW) gasa je oslobođeno na smeši aluminijuma sa nepoznatim monovalentnim metalom, a masa smeše je prepolovljena. Kada se ostatak tretira razblaženom azotnom kiselinom, oslobađa se 0,373 dm 3 (NU) NO. Identifikovati nepoznati metal.
53. Masa uzorka krede je 105 g, a hemijska količina elementa kiseonika u njegovom sastavu je 1 mol. Odrediti maseni udio CaCO 3 u uzorku krede (kisik je uključen samo u sastav kalcijevog karbonata).
54. U interakciji sumpor oksida (VI) sa vodom, dobijeno je rastvor sa masenim udjelom sumporne kiseline od 25%. Kada se tom rastvoru doda suvišak Ba (OH) 2, taloži se talog od 29,13 g. Koje mase SO3 i H20 su potrošene na formiranje kiselinskog rastvora?
55. Kada je prolazio SO2 kroz 200 g rastvora sa masenim udjelom NaOH od 16%, formirana je mješavina soli, uključujući 41,6 g kiselinske soli. Kolika je masa sumpora koji sadrži 4,5% nečistoća po masi, korištena je za dobivanje SO2? Kolika je težina srednje soli?
56. Interakcija sa 80 g Ca (NO 3) 2 rastvora je uzela 50 g rastvora Na2C03. Precipitacija je odvojena, dok je obrada sa suviškom klorovodične kiseline oslobođena 2,24 dm 3 (NU) plina. Koji su maseni udjeli soli u početnim otopinama? Koliki je maseni udio natrijum nitrata u otopini nakon odvajanja taloga?
57. Kada je cink u interakciji sa sumpornom kiselinom, formira se 10 dm 3 (NU) smeše SO2 i H2S sa relativnom gustinom argona od 1,51. Kolika je količina rastvorenog cinka? Koliki je maseni udio SO 2 u mješavini plina?
58. Uzorak mješavine piljevine od cinka i aluminija ukupne mase 11 g otopljen je u suvišku otopine alkalija. Odredite zapreminu (NU) oslobođenog gasa, ako je maseni udio cinka u smeši 30%.
59. Natrijum hidroksid mase 4,0 g legiran je aluminijum hidroksidom težine 9,8 g. Izračunati masu dobijenog natrijum metaaluminata.
60. Pri preradi 10 g smjese bakra i aluminija s koncentriranom dušičnom kiselinom u sobnoj temperaturi oslobođen 2.24 dm 3 gasa (NU). Koja zapremina (NU) gasa će biti oslobođena kada se obradi ista masa smeše sa viškom rastvora KOH?
61. Legura bakra i aluminija težine 20 g tretirana je suviškom alkalija, nerastvorni ostatak je otopljen u koncentriranoj dušičnoj kiselini. Dobijena sol je izolovana, kalcinirana do konstantne težine i dobijeno je 8 g čvrstog ostatka. Odrediti zapreminu potrošenog rastvora NaOH sa masenim udjelom od 40% i gustoćom od 1,4 g / cm3).
62. Mešavina aluminijuma i metalnog oksida (II) (ne-amfoterni oksid) mase 39 g tretirana je suviškom otopine KOH, emitovani plin je spaljen da bi se dobilo 27 g vode. Neotopljeni ostatak je potpuno rastvoren u 25,2 cm3 rastvora sa masenim udjelom HC1 od 36,5% i gustoćom od 1,19 g / cm3). Odredite oksid.
63. Mešavina cinkovog i bakarnog čipsa je tretirana sa suviškom otopine KOH, dok je oslobođen plin od 2.24 dm 3 (NU). Za potpuno hlorisanje istog uzorka metala bio je potreban hlor sa zapreminom od 8,96 dm 3 (NU). Izračunajte maseni udio cinka u uzorku.
64. Mešavina piljevine željeza, aluminija i magnezijuma mase 49 g tretirana je viškom razrijeđenog H2S04, čime je dobiveno 1,95 mol plina. Drugi dio iste smjese težine 4,9 g tretiran je suviškom alkalne otopine, dobiveno je 1,68 dm 3 (NU) plina. Pronađite masu metala u smeši.
65. Kolika je masa nastalog sedimenta pri spajanju otopina koje sadrže 10 g NaOH i 13,6 g ZnCl2?
66. Postoje dva dijela mješavine Al, Mg, Fe, Zn, isti u molarnom sastavu, svaki težak 7,4 g. Jedan dio je otopljen u klorovodičnoj kiselini i dobiveno je 3.584 dm3 plina (NU), a drugi u alkalnoj otopini i Dobio 2.016 dm 3 plina (NU). Poznato je da u obe smeše ima 3 Zn atoma po atomu A1. Pronađite masu metala u smeši.
67. Mešavina bakra, magnezijuma i aluminijuma težine 1 g tretirana je viškom hlorovodonične kiseline. Rastvor je filtriran, u filtrat je dodan višak rastvora NaOH. Precipitat je odvojen i kalciniran do konstantne mase 0,2 g. Ostatak, koji je nakon obrade sa hlorovodoničnom kiselinom nerastvoren, kalcinisan je na vazduhu i dobijeno je 0,8 g crne supstance. Pronađite maseni udio aluminija u smjesi.
68. Kada se zagreva u struji legure cinka, magnezijuma i bakra u kiseoniku, masa smeše se povećava za 9,6 g. 3 Za reakciju s istim dijelom legure potreban je 0,7 mol HC1. Nađite hemijske količine metala u leguri.
69. Legura bakra i cinka težine 5 g tretirana je suviškom otopine NaOH. Zatim se kruti ostatak izdvoji i tretira koncentriranim HN03, tako dobivena sol se izolira, kalcinira do konstantne težine i dobije se 2,5 g krutog ostatka. Odredite masu metala u leguri.
70. Legura bakra i aluminija težine 12,8 g tretirana je suviškom klorovodične kiseline. Neotopljeni ostatak je rastvoren u koncentrovanoj azotnoj kiselini, nastali rastvor je isparen, suhi ostatak je kalciniran do konstantne težine i dobijeno je 4 g čvrste supstance. Odredite maseni udio bakra u leguri.
71. U kojem omjeru mase treba uzeti dva dijela A1, tako da kada se jedan doda u otopinu lužine, a drugi u jednaku količinu vodika, ispuštaju se u klorovodičnu kiselinu?
72. Prilikom obrade mješavine aluminija i bakar (II) oksida sa suviškom otopine KOH, oslobođeno je 6,72 dm3 (NU) plina, a otapanjem istog dijela smjese u koncentriranom HNO 3 na sobnoj temperaturi, dobiveno je 75,2 g soli. Nađite masu početne smjese tvari.
73. Koja se masa bakar (II) oksida može obnoviti vodikom dobivenim reakcijom viška aluminija sa 139.87 cm3 otopine sa 40% NaOH i gustoće od 1.43 g / cm3?
74. Uz potpunu oksidaciju 7,83 g legure dva metala, formirano je 14,23 g oksida, pri čemu je za tretman viška alkalija ostala nerazređena 4,03 g sedimenta. Odredite kvalitativni sastav metala koji formiraju leguru, ako njihovi kationi imaju oksidaciono stanje +2 i +3, a molarni odnos oksida je 1: 1 (pretpostavimo da oksidni oksidni status +3 ima amfoterna svojstva).
75. Dva dela aluminijuma, koji imaju istu masu, rastvorena su: jedan u rastvoru kalijum hidroksida, a drugi u hlorovodoničnoj kiselini. Kako se količine evoluiranih gasova (nos) odnose jedna na drugu?
76. Legura bakra sa aluminijumom težine 1.000 g tretirana je suviškom alkalne otopine, neotopljeni talog je otopljen u dušičnoj kiselini, zatim je otopina isparena, ostatak je kalciniran do konstantne težine. Masa novog ostatka je 0,398 g. Koja je masa metala u leguri?
77. Legura cinka i bakra težine 20 g tretirana je suviškom otopine NaOH sa masenim udjelom od 30% i gustoćom od 1,33 g / cm3. Čvrsti ostatak je izolovan i tretiran sa viškom koncentrovanog rastvora HNO3. Sol koja je nastala tokom ovog procesa je izolovana i kalcinirana do konstantne težine. Masa čvrstog ostatka je 10.016 g. Izračunajte masene udjele metala u leguri i potrošenu količinu alkalne otopine.
78. Legura bakra i aluminija težine 2 g tretirana je suviškom alkalne otopine. Ostatak je filtriran, ispran, rastvoren u HNO3, rastvor je uparen i kalciniran do konstantne težine. Masa ostatka nakon kalcinacije iznosila je 0,736 g. Izračunati masene udjele metala u leguri.
79. Hlorisanje mešavine gvožđa, bakra i aluminijuma zahteva 8,96 dm3 hlora (NU), a interakcija istog uzorka sa hlorovodonikom zahteva 5,6 dm 3 (NU). U interakciji s istom masom mješavine metala s alkalijama, oslobađa se 1,68 dm 3 (NU) plina. Nađite hemijske količine metala u smeši.
80. Kalijum hidrid težine 5,0 g je rastvoren u vodi zapremine 80 cm 3 i aluminijumu težine 0,81 g je dodato u dobijeni rastvor.Nađite masene frakcije supstanci u dobijenom rastvoru sa tačnošću do hiljaditih procenata.
LISTERATURA
1. Barannik, V.P. Moderna ruska nomenklatura neorganskih jedinjenja / V.P. Barannik // Časopis All-Union Chemical Society. D.I. Mendeleev. - 1983. - XXVIII. - str.
2. Wroblewski, A.I. Simulator hemije / A.I. Wroblewski. - 2. izdanje, Pererab. i dodaj. - Minsk: Krasiko-Print, 2007. - 624 str.
3. Glinka, N.L. Zadaci i vježbe iz opće kemije: studije. priručnik za univerzitete / ed. V.A. Rabinovich i H.M. Rubina. - M .: Integral-Press, 2004. - 240 str.
4. Lidin, R.A. Zadaci u opštoj i neorganskoj hemiji: studije. priručnik za studente viših. studije. institucije / R.A. Lidin, V.A. Milk, L.L. Andreeva; by ed. R.A. Lidina. - M .: VLADOS, 2004. - 383 str.
5. Lidin, R.A. Osnove nomenklature neorganskih supstanci / R.A. Lidin [et al.]; by ed. B.D. Stepina. - M .: Chemistry, 1983. - 112 str.
6. Stepin, B.D. Primjena IUPAC pravila na nomenklaturu neorganskih spojeva na ruskom / B.D. Stepin, R.A. Lidin // Časopis All-Union Chemical Society. D.I. Mendeleev. - 1983. - XXVIII. - str.
| Uvod …………………………………………………………………… Opća pravila za asortiman neorganskih supstanci ………… .. Oksidi ………………………………… ……………………………… Osnovni oksidi ………………………………………………………… ... Kiseli oksidi ………………………………… ………………………. Amfoterni oksidi ……………………………………………………… .. Dobijanje oksida ………………………………………………………… Vježbe za samostalan rad na Tema “Oksidi” ……………………………………………………. Kiseline ……………………………………………………………………. Vežbe za samostalni rad na temu “Kiseline” ……………………………………………………………………………………………… ……… .. Vježbe za samostalni rad na temu „Temelji“ ………………………………………………………. Soli …………………………………………………………………………. Vježbe za samostalni rad na temu "Soli" .......................................................... Genetski odnos između klasa neorganskih spojeva ......................................... …………… .. Vježbe za samostalni rad na temu „Genetska povezanost klasa neorganskih spojeva“ ……………………………………………… Eksperimentalni eksperimenti na temu „Glavne klase neorganskih spojeva …………… ……… .. Zadaci poravnanja …………………………………………………………… Literatura ……………………………………………… |
edukativni: fiksirati pojam "genetičke serije", "genetičke veze"; naučiti kako napraviti genetske nizove elemenata (metali i nemetali), da bi se napravile jednadžbe reakcije koje odgovaraju genetskoj seriji; provjeriti kako se usvajaju znanja o kemijskim svojstvima oksida, kiselina, soli, baza;
razvoj: razviju sposobnost analiziranja, upoređivanja, sumiranja i donošenja zaključaka, sastavljanja jednačina hemijskih reakcija;
edukativni : promovišu formiranje naučnog pogleda na svet.
2. Pružanje nastave: tabele „Periodni sistem“, „Tabela rastvorljivosti“, „Serija aktivnosti metala“, uputstva za studente, zadaci za testiranje znanja.
3. Redoslijed izvršenja:
3.1. Frontal survey.
3.2. Rješenje zadataka.
3.3. Obavite rad na verifikaciji opcija.
4. Izgled izvještaja:
4.1. Zabilježite temu i ciljeve prakse.
4.2. Rešavanje problema.
4.3. Rešite svoju verziju nezavisnog rada, odluku da pišete u svesku i prenesite nastavniku na pregled.
Napredak u radu
1. Frontalni razgovor o:
Šta je genetska veza?
Genetske veze - to su veze između različitih klasa na osnovu njihovih interkonverzija.
Šta je genetska serija?
Genetic row - niz supstanci - predstavnici različitih klasa, koji su jedinjenja jednog hemijskog elementa, povezani međusobnim konverzijama i reflektujućim transformacijama ovih supstanci. Osnova ovih serija je isti element.
Koje vrste genetskih serija se obično dodjeljuju?
Među metalima postoje dvije vrste redova:
a) Genetska serija u kojoj alkali djeluju kao baza. Ova serija može biti predstavljena korištenjem sljedećih transformacija:
metal → osnovni oksid → alkalni → sol
na primjer, genetska serija kalija K → K 2 O → KOH → KCl
b) Genetska serija, gde je baza nerastvorna baza, onda se serija može predstaviti kao lanac transformacija:
metal → osnovni oksid → sol → nerastvorna baza → osnovni oksid → metal
na primjer: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
Od nemetala moguće je razlikovati i dva tipa redova:
a) Genetska serija nemetala, gde rastvorljiva kiselina deluje kao veza u seriji. Lanac transformacija može se predstaviti na sledeći način: nemetalni → kiseli oksid → rastvorljive kiseline → soli.
Na primjer: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) Genetski red nemetala, gde nerastvorna kiselina: nemetalni → kiseli oksid → sol → kiselina → kiseli oksid → nemetalni deluje kao veza u seriji
Na primjer: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Izvršavanje zadataka za opcije:
| Opcija 1 | Opcija 2 |
|
I opcija: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
Opcija II: Na2SO4, NaOH, Na, Na2O2, Na2O
Domaći zadatak: skicirati postepeni prelaz sa kalcijuma na kalcijum karbonat i pripremiti izvještaj o upotrebi bilo koje soli u medicini (koristeći dodatnu literaturu).
Uputstva za praktičnu nastavu
Genetski odnos između glavnih klasa neorganskih supstanci.
Ciljevi: fiksirati pojam "genetičke serije", "genetičke veze"; nauče da prave genetske nizove elemenata (metali i nemetali), da sastave jednadžbe reakcije koje odgovaraju genetskoj seriji; ponoviti svojstva oksida, kiselina, soli, baza.
Napredak u radu
Zapišite definicije pojmova:
Genetski odnos - __________________________________________
Genetski red - ___________________________________________
Genetska serija metala u kojoj alkali deluju kao baza. može se općenito predstaviti: metalni → osnovni oksid → alkalni → sol. Napravite ovu seriju koristeći kalijum. Napišite jednadžbe reakcija, pomoću kojih možete ostvariti ovaj lanac transformacija.
Genetska serija nemetala, gde rastvorljiva kiselina deluje kao veza u seriji može se predstaviti na sljedeći način: ne-metalni → kiseli oksid → topljiva kiselina → sol. Napravite ovu seriju koristeći fosfor. Napišite jednadžbe reakcija, pomoću kojih možete ostvariti ovaj lanac transformacija.
Genetski red, gde je baza nerastvorna baza može se predstaviti lancem transformacija: metal → osnovni oksid → sol → nerastvorna baza → osnovni oksid → metal. Napravite ovu seriju koristeći bakar. Napišite jednadžbe reakcija, pomoću kojih možete ostvariti ovaj lanac transformacija.
Genetska serija nemetala, gde nerastvorna kiselina deluje kao veza u seriji može se predstaviti lancem transformacija: nemetalni → kiselinski oksid → sol → kiselina → kiseli oksid → nemetalni. Izgradite ovu seriju koristeći silicijum. Napišite jednadžbe reakcija, pomoću kojih možete ostvariti ovaj lanac transformacija.
Obavljajte zadatke za opcije:
| Opcija 1 | Opcija 2 |
|
1. Izaberite formulu oksida u vašoj verziji, objasnite svoj izbor, na osnovu znanja o karakteristikama sastava ove klase jedinjenja. Zovi ih.
2. U koloni formule vaše varijante, pronađite formule kiseline i objasnite svoj izbor na osnovu analize sastava ovih jedinjenja.
3. Utvrditi valencije kiselinskih ostataka u kiselom sastavu.
4. Izaberite formule soli i navedite ih.
5. Napravite formule soli koje se mogu formirati magnezijumom i kiselinama iz vaše varijante. Zapišite ih.
6. U stupcu formule vaše varijacije, pronađite osnovne formule i objasnite svoj izbor na osnovu analize sastava ovih spojeva.
7. U vašoj varijanti izaberite formule supstanci sa kojima može reagovati rastvor ortofosforne kiseline (hlorovodonična, sumporna). Napravite odgovarajuće jednačine reakcije.
9. Među formulama vaše opcije, odaberite formule supstanci koje mogu međusobno djelovati. Napravite odgovarajuće jednačine reakcije.
10. Napravite lanac genetičkih veza neorganskih jedinjenja, koji će sadržati supstancu, čija je formula data u vašoj verziji pod brojem jedan.
Od ovih supstanci napravite genetsku liniju koristeći sve formule. Napišite reakcije jednačina pomoću kojih možete ostvariti ovaj lanac transformacija:
I opcija: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
IIopciju: Na 2 SO 4, NaOH, Na, Na2O2, Na2O
Domaći zadatak: skicirati postepeni prelaz sa kalcijuma na kalcijum karbonat i pripremiti izvještaj o upotrebi bilo koje soli u medicini (koristeći dodatnu literaturu).
