Shema strukture silicija. Struktura elektrona
Atomska struktura Položaj u PS: period III; grupa IV; Naboj kernela: +14 Si; Relativna atomska masa: Ar (Si) = 28 Atomska struktura: p = 14, e = 14, n = = 14 Elektronska formula: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
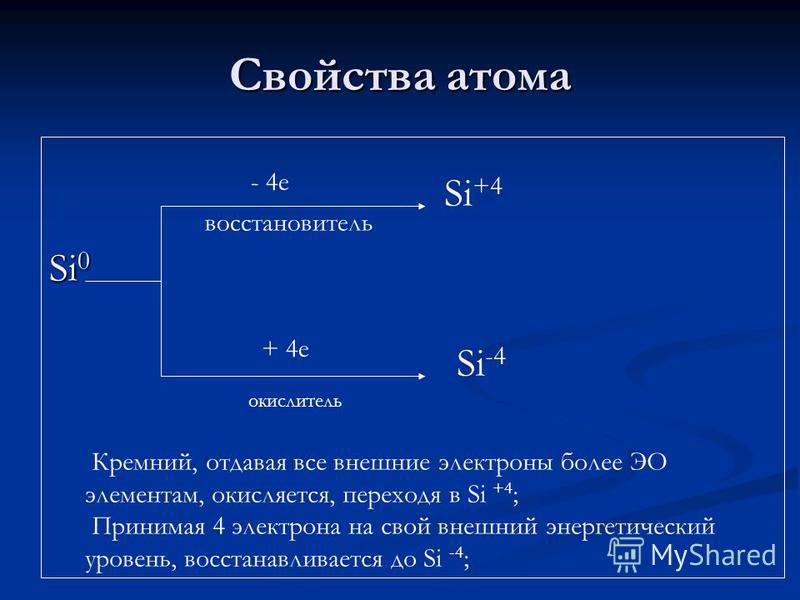
Atomska svojstva Si e redukcijski agens + 4 e oksidant Si + 4 Si -4 Silicijum, koji daje sve vanjske elektrone više EO elementima, oksidira, prelazeći u Si + 4; Uzimajući 4 elektrona na svoj spoljašnji nivo energije, redukuje se na Si-4;

Fizičke osobine silikona Silicij je nemetalni, postoji u kristalnom i amorfnom stanju. Kristalni silikon je sivkasto-čelična supstanca sa metalnim sjajem, vrlo tvrd, ali krhak. Amorfni silicijum-braon prah. p = 2,33 g / cm3; t pl. = C; t kip. = C;

Kristalna struktura silikona Kristalna rešetka silikona je kubični tip dijamantnog centra. Ali zbog dužine dužine veze između Si - Si, tvrdoća silicija je znatno manja od tvrdoće dijamanta. Silicij je krhak samo kada se zagrijava iznad C.

Electro fizička svojstva Elementarni silicijum Elementarni silicijum je tipičan poluvodič. tipični poluvodič. Elektrofizička svojstva kristalnog silicijuma su pod velikim uticajem nečistoća u tragovima. Za dobijanje silikonskih monokristala sa p-tipom provodljivosti, aditivi elemenata 3. grupe bora, aluminijuma, galijuma i indijuma, sa elektronskom provodljivošću aditiva, uvode se u silicijum elementi V grupe fosfora, arsena ili antimona.


Flint Flint, ovaj Flint, ovaj ružan i veoma ružan i vrlo izdržljiv kamen, izdržljiv kamen, postavio je temelj kamenom početku kamenog doba - stoljeću - stoljeću kremenih radnih alata. alati od kremena Postoje dva razloga: - prevalencija i dostupnost silicija; - prevalencija i dostupnost silicija; - mogućnost oblikovanja oštrih reznih rubova kada se usitne; - mogućnost oblikovanja oštrih reznih rubova kada se usitne;




Da li znate da je metod za dobijanje silikona u svom čistom obliku razvio Nikolaj Nikolayevic Beketov. Silicijum u Rusiji se proizvodi u tvornicama: Kamensk - Uralsky (Regija Sverdlovsk) Kamensk - Uralsky (Regija Sverdlovsk) Shelekh (Regija Irkutsk). Shelekh (Irkutsk region).

Proizvodnja silikona U industriji, silicij se dobija redukcijom taline SiO2 koksom na t = C u elektrolučnim pećima. Čistoća tako dobivenog silicija iznosi 99,9%.
Dobijanje silikona Laboratorijska metoda proizvodnje: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Kemijska svojstva silicija Kada se zagreva na 400 - C, silicij reaguje sa kiseonikom i formira silicijum dioksid: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
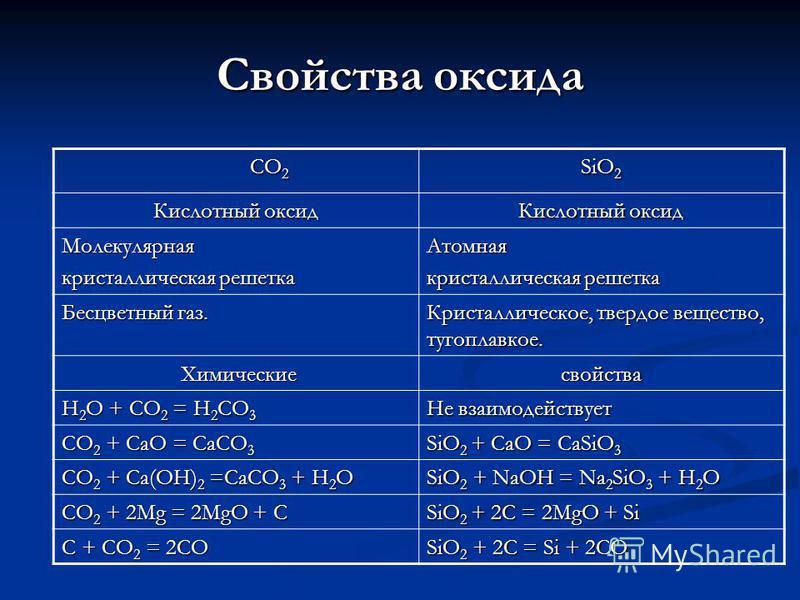
Svojstva CO 2 CO 2 SiO 2 oksida Kiselinski oksid Molekularna kristalna rešetka Atomski bezbojni plin. Kristalni, čvrsti, vatrostalni. Hemijska hemijska svojstva H 2 O + CO 2 = H 2 CO 3 Ne reaguje na CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
Svojstva kiselina H 2 CO 3 H 2 SiO 3 Dibazična, kisikova, slaba, krhka, od leti. Dibazično, slabo sadržano u kiseoniku, slabo, nerastvorljivo u vodi. Primanje: CO 2 + H 2 O = H 2 CO 3 Primanje: SiO 2 + H 2 O = ne može biti nestabilno, lomljivo, razgrađuje se pri stajanju ili zagrijavanju: H 2 CO 3 = CO 2 + H 2 O Ne može se odabrati u čistom obliku, jer razgrađuje se pri zagrijavanju: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Manja evolucija plina __________

Silikatne kiseline Ugljene kiseline - Karbonati; - ugljovodonici; - silikati; - silikati; Karbonati imaju sva svojstva soli, jaki su elektroliti, potpuno disociraju na ione (rastvorljivi u vodi). Samo soli alkalnog metala su rastvorljive, druge formiraju nerastvorljive ili uopšte ne formiraju soli (Al +3, Cr +3, Ag +).
![]()



Biološka uloga Najvažnije silikonsko jedinjenje, SiO 2, je neophodno za biljni i životinjski život. Zahvaljujući njemu, trstici, trstici Zahvaljujući njemu, trstici, trska i preslice čvrsto stoje kao bajonete. i horsetails stajati čvrsto, kao bajoneta. Oštri šašasti listovi isječeni kao oštri šašasti listovi isječeni kao noževi, strnjika na pokošenim terenskim noževima, strnjika na pokošenim terenskim ubodima poput igala, i stabljike žitarica kao štapići, a stabljike žitarica toliko jake da ne dopuštaju tako jake ne dozvolite da polje u poljima pada s kiše i polja vjetra u poljima da odu od kiše i vjetra


Silicij je element u tragovima koji se stalno nalazi u ljudskom tijelu. Najveća količina se nalazi u limfnim čvorovima, vezivnom tkivu aorte, traheje, kose i kože. Silicij je potreban za izgradnju epitelnih ćelija. Silicij je element u tragovima koji se stalno nalazi u ljudskom tijelu. Najveća količina se nalazi u limfnim čvorovima, vezivnom tkivu aorte, traheje, kose i kože. Silicij je potreban za izgradnju epitelnih ćelija. Silicijum igra važnu ulogu u procesu mineralizacije kostiju; neophodno za održavanje elastičnosti arterijskog zida, ima pozitivan učinak na imuni sistem i usporava proces starenja u tkivima ljudskog tijela. Prosječan sadržaj silicija u krvi je 8,25 mg / dan. Sa godinama se njegov nivo u telu smanjuje, tako da kod starijih ljudi potreba za silicijumom ima tendenciju povećanja. Poboljšajte apsorpciju silikona u telu uz prisustvo kalcijuma, magnezijuma, mangana i kalijuma. Silicijum igra važnu ulogu u procesu mineralizacije kostiju; neophodno za održavanje elastičnosti arterijskog zida, ima pozitivan učinak na imuni sistem i usporava proces starenja u tkivima ljudskog tijela. Prosječan sadržaj silicija u krvi je 8,25 mg / dan. Sa godinama se njegov nivo u telu smanjuje, tako da kod starijih ljudi potreba za silicijumom ima tendenciju povećanja. Poboljšajte apsorpciju silikona u telu uz prisustvo kalcijuma, magnezijuma, mangana i kalijuma.

Biološka uloga silikona je takođe uključena u sastav nižih živih organizama - dijatomeje i radiolarije - najdelikatnijih kvržica žive materije, koje stvaraju njihove nenadmašne lepotne kosture napravljene od silicijum dioksida. Silicijum je takođe deo nižih živih organizama - dijatomeja i radiolarija - najdelikatnijih kvržica žive materije, koje stvaraju svoju nenadmašnu lepotu kostura silike. Dijatomeje Radiolaria Samokontrola 1. Koje je mesto silikona u periodičnom sistemu: a) 2 perioda, 4 og. b) 3 perioda, 3 gr. poglavlje. c) 3 perioda, 4 gr. poglavlje) 2 period, 4 gr. b) 3 perioda, 3 gr. poglavlje. c) 3 perioda, 4 gr. poglavlje. 2. Silikonska rešetka: a) ionska; b) atomska; c) molekularna; a) ionski; b) atomska; c) molekularna; 3. Prema prevalenciji u prirodi silicija ... element: a) prvi; b) drugi; c) treći; a) prvi; b) drugi; c) treći; 4. Silikon reaguje sa: a) metalima, vodonikom, halogenima; a) metali, vodici, halogeni; b) metale, halogene, lako rastvorljive u alkalijama; b) metale, halogene, lako rastvorljive u alkalijama; c) oksidi, kiseline, nemetali. c) oksidi, kiseline, nemetali. 5. Silikatne kiseline: a) silicidi; b) hidrosilikati; c) silikati; a) silicidi; b) hidrosilikati; c) silikati;

Silicon.
Silicon - element glavne podgrupe IV grupe trećeg perioda periodičnog sistema hemijskih elemenata DI Mendeleev, sa atomskim brojem 14, atomska masa: 28.0855. U jedinjenjima obično pokazuje stepen oksidacije +4 (valenca IV) i vrlo rijetko +3, +2 i +1 (valencije, odnosno III, II i I). U periodnom sistemu, Mendelejev silicij se nalazi u grupi IVA (A-označava da je ovo glavna podgrupa) (u grupi ugljika), u trećem periodu. Nemetall . Označava se simbolom Si(lat Siliconium). U slobodnom obliku - smeđi prah ili svijetlo sivi kompaktni materijal s metalnim sjajem. Struktura rešetke: kubni, dijamant.
Glavno stanje: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, p-element.
2. Fizička svojstva.
Kristalni silicij je tamno siva supstanca sa čeličnim sjajem. Struktura silikona slična je strukturi dijamanta. U svom kristalu, svaki atom je okružen četverostrukim tetraedrama i povezan je s njima kovalentnom vezom, koja je mnogo slabija nego između ugljikovih atoma u dijamantu. U silikonskom kristalu, čak i pod normalnim uvjetima, neke od kovalentnih veza su uništene. Zbog toga ima slobodne elektrone, koji uzrokuju malu električnu provodljivost. Kada se osvetljenje i grejanje povećaju broj slomljenih veza, što znači da se broj slobodnih elektrona povećava i električna provodljivost se povećava. Tako bi trebalo objasniti poluvodičke osobine silicija.
Silicij je vrlo krhak, njegova gustina iznosi 2,33 g / cm3. Kao i ugalj, odnosi se na vatrostalne supstance.
Silicijum se sastoji od tri stabilna izotopa: 2814Si (92.27%), 2914Si (4.68%) i 3014Si (3.05%).
3. Biti u prirodi.
Najčešće u prirodi, silicij se nalazi u obliku silica - jedinjenja na bazi silicijum dioksida (IV) SiO2 (oko 12% mase zemljine kore). Glavni minerali i stijene koje formira silicijum dioksid su pijesak (rijeka i kvarc), kvarc i kvarcit, kremen i feldspat. Prirodni silikati imaju složen sastav i strukturu. Ovdje je sastav nekih prirodnih silikata:
ü feldspar K 2 O × Al 2 O 3 × 6SiO 2,
as azbest 3MgO × 2SiO 2 × 2H 2 O,
K mica K 2 O × 3Al 2 O 3 × 6 SiO 2 × 2H 2 O,
ü kaolinit 3Al 2 O 3 × 2SiO 2 × 2H 2 O.
Druga najzastupljenija grupa u prirodi silikonskih jedinjenja je silikati i aluminosilikati
Zabilježene su jedinstvene činjenice pronalaženja čistog silicija u izvornom obliku.
4. Hemijska svojstva silicija i njegovih spojeva.
By kemijska svojstva silicij, kao i ugljenik, je nemetal, ali je njegov nemetal manje izražen, budući da ima veći atomski radijus. Budući da atomi silikona imaju 4 elektrona na vanjskom energetskom nivou, oksidacijsko stanje i -4 i +4 je karakteristično za silicij (poznato je silikonsko jedinjenje, gdje je njegov stupanj oksidacije +2).
Silicij u normalnim uslovima je prilično inertan, što treba objasniti jačinom kristalne rešetke. On direktno stupa u interakciju samo sa fluor:
Kiseline (osim mješavine fluorovodične HF i dušične HNO 3)silicij ne deluje. Međutim, rastvara se u hidroksidima alkalnih metala, formirajući silikat i vodik:
Od dvije alotropne modifikacije silicija, kristalnog i amorfnog, amorfni silicij je kemijski aktivniji. On reaguje kisikom kada se zagrije, formira se SiO 2:
kao i sa svima halogenina primjer:
![]()
Na visokoj temperaturi silikon povezuje sa ugljenikomformiranje karborunduma SiC:
Karborund ima kristalnu rešetku sličnu dijamantu, u kojoj je svaki atom silicija okružen sa četiri atoma ugljenika i obrnuto, a kovalentne veze su veoma jake, kao u dijamantu. Zbog toga je u tvrdoći blizu dijamanta. Brusni kamen i brusne ploče izrađeni su od silicijum karbida.
Magnezijum silicid. U reakcijama sa aktivnim metalima, javljaju se sa formiranjem silicidi, Silicijum djeluje kao oksidant:
Na visokim temperaturama silicij oporavlja mnoge metale iz njihovih oksida. (!!!)
Silane Pod dejstvom hlorovodonične kiseline na silicide, najjednostavnije vodonično jedinjenje silicija je silan SiH 4:
Silan je otrovni plin sa neugodnim mirisom, samozapaljivim u zraku (!!!):
Silicijum oksid (IV).Naziva se i oksid silicija (IV) silica. To je čvrsta vatrostalna supstanca. (tačka topljenja 1700 ° C) rasprostranjena u prirodi u dva oblika:
1) kristalni silicijev dioksid - u obliku minerala kvarca i njegovih sorti (kameni kristal, kalcedon, ahat, jaspis, kremen); Kvarc je osnova kvarcnog pijeska široko korištenog u građevinarstvu i silikatna industrija;
2) amorfni silicijum dioksid - u obliku opalnog mineralnog sastava SiO 2 × n H 2 O; zemljani oblici amorfnog silicijuma su diatomit, tripoli (infuzorijska zemlja); primjer umjetnog amorfnog bezvodnog silicijevog dioksida je silikagel, koji se dobiva iz natrijevog metasilikata:
Silikagel ima razvijenu površinu i stoga dobro upija vlagu. .
Na 1710 ° kvarc se topi. Uz brzo hlađenje nastaje rastopljena masa kvarcno staklo . Ima veoma nizak koeficijent ekspanzije, tako da vruće kvarcno staklo ne puca kada se voda brzo ohladi. Laboratorijsko stakleno posuđe i instrumenti za naučna istraživanja izrađeni su od kvarcnog stakla.
Najjednostavnija formula silicijum oksida (IV) SO2 je slična formuli ugljičnog monoksida (IV) CO 2. U međuvremenu, njihove fizičke osobine su veoma različite (SiO2 - čvrsti, CO 2 - gas). Ova razlika se objašnjava strukturom kristalnih rešetki. C0 2 kristalizira u molekularnoj rešetki, SiO2 - u atomskom. Struktura SiO 2 u ravnoj slici može se predstaviti na sljedeći način:
Koordinacioni broj atoma ugljenika u čvrstom CO 2 je 2, a silicij u SiO2 je 4. Svaki atom silicija je zatvoren u tetraedron od 4 atoma kiseonika. Istovremeno, atom silikona je u centru, a atomi kiseonika se nalaze na vrhovima tetraedra . Cijeli komad silike se može smatrati kristalom čija je formula (SiO2) n. Ova struktura silicijum oksida (IV) određuje njegovu visoku tvrdoću i vatrostalnost .
Kemijska svojstva silicijevog oksida (IV) SiO2 se odnosi na kisele okside. Prilikom fuzije sa čvrstim alkalijama, baznim oksidima i karbonatima, formiraju se silikatne kiseline:
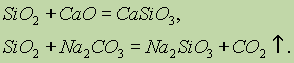
Samo fluorovodična kiselina u interakciji sa silicijum oksidom (IV):
Ova reakcija se koristi za rezanje stakla. .
Silicij (IV) se ne otapa u vodi i ne komunicira s njom kemijski. (!!!) Stoga se silicijumska kiselina dobiva indirektno djelovanjem kiseline na otopinu kalijevog ili natrijevog silikata:
U ovom slučaju, silicijumska kiselina (u zavisnosti od koncentracije početnih rastvora soli i kiseline) može se dobiti i u obliku želatinozne mase koja sadrži vodu, i u obliku koloidnog rastvora (sol).
Silicic acid. SiO2 je anhidrid određenog broja silicijumskih kiselina, čiji se sastav može izraziti općom formulom: xSiO 2 × yH 2 O, gdje x i y - cijeli brojevi:
1) x = 1, y = 1: SiO 2 × H 2 O, tj. H 2 SiO 3 - metasilicic acid;
2) x = 1, y = 2: SiO 2 × 2H 2 O, tj. H 4 SiO 4 - ortosilikatna kiselina;
3) x = 2, y = 1: 2SiO 2 × H 2 O, tj. H 2 Si 2 O 5 - bimetakrinska kiselina.
Silikatna kiselina se gradi iz tetraedarnih strukturnih jedinica (u svakoj takvoj jedinici atom silicija se nalazi u središtu tetraedra, a na vrhu su atomi kiseonika). Strukturne veze, koje se spajaju u lancima, formiraju stabilnije polisilicijske kiseline:
Sastav takvih jedinjenja može se izraziti formulom (H 2 SiO 3) n. Međutim, obično silicijumska kiselina je predstavljena formulom H 2 SiO 3. H 2 SiO 3 - kiselina je vrlo slaba, slabo topljiva u vodi. Kada se zagreva, lako se razlaže kao karbonska kiselina
Sve silicijske kiseline su veoma slabe (slabije od uglja).
Silikati. Nazivaju se soli svih silicijumskih kiselinasilikatimada, u pravilu, u obrazovnoj literaturi silikati podrazumevaju soli metacilikinske kiseline. Njihov sastav je obično predstavljen formulom u obliku jedinjenja oksida elemenata. Na primjer, kalcijev silikat CaSiO 3 može se izraziti kao: CaO × SiO 2.
Silikati u sastavu R 2 O × nSiO 2, gdje R 2 O - oksidi natrija ili kalija , se zovu topljivo staklo , a njihove koncentrirane vodene otopine - tekuće staklo . Najvažnije je staklo natrijum-soda..
Kada stoje na vazduhu, rastvori silikata postaju mutni, jer ugljen dioksid (IV) u vazduhu zamenjuje silicijumsku kiselinu iz njenih soli:
Silikatna kiselina je praktično nerastvorljiva u vodi - ovo svojstvo se koristi kao kvalitativna reakcija na ion SiO 3 2-.
Silikati se dobijaju fuzijom silicijum dioksida sa alkalijama ili karbonatima:
5. Otkriće iona SiO 3 2. (ne mogu naći ništa ...)
6. Uloga silicijumskih jedinjenja u formiranju tla i šumarstvu.
Magmatske stijene su prilično stabilne u svom sastavu i sadrže uglavnom spojeve silicija, aluminija, željeza, alkalija, magnezija i kalcija. Prema sadržaju Si0 2, magmatske stijene se dijele u četiri grupe: kisele (\u003e 65%), srednje (52-65%), bazične (40-52%) i ultrabazične (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Kisele magmatske stijene- graniti, pegmatiti, rioliti, dacit i drugi - obično imaju svijetlo smeđu boju s izraženim kristalima kvarca, feldspata, tinjca. Sadržaj SiO 2 u njima je visok (više od 65%) sa značajnom količinom kalijuma i natrijuma. Istovremeno, malo gvožđa i kalcijuma i magnezijuma su zanemarljivi. Zemljišta na kiselim magmatskim stijenama, na primjer, na granitima, razlikuju se u ranim fazama raspadanja zbog krhkosti, šljunčanog karaktera izvora. Kada se troši u vlažnim uslovima, lako gube alkalno-zemaljske elemente, zbog čega je zemlja na takvim podlogama (eluvijum stijena) izuzetno siromašna, slabo plodna.
Glavne magmatske stijene -bazalt, gabro, itd., po pravilu, imaju tamnu (do crnu) boju. Odlikuju se manjim sadržajem SiO2 u poređenju sa kiselim stijenama. Glavne magmatske stijene su relativno bogate spojevima željeza, mangana, kroma, kobalta, cinka, titana, nikla, bakra. Proizvodi njihove atmosferilije vrlo brzo dobijaju karakter gline, dugo zadržavaju alkalnu i neutralnu reakciju i odlikuju se povećanim sadržajem minerala humusa i gline. Tlo na takvim stijenama je plodnije.
Pored kiselih i osnovnih vrsta često se pronalaze magmatske stijene prijelaznog tipa(srednja) - intruzivne stijene dioritne grupe i njihovi izlučni kolege - andeziti. Prema tome, tla na ovim stijenama dobijaju karakteristike slične onima ograničenim na kisele ili osnovne stijene. Mnogo rjeđe ultrabazične pasmine:peridotiti i pikriti, koji imaju najniži sadržaj SiO2.
Metamorfne stijene -tranzicijski između masivnih kristalnih i sedimentnih stijena. Drevne sedimentne stijene pod ronjenjem, visoki tlak i temperature se metamorfiziraju, formirajući gnajse, serpentinite, mramor, kvarcite, škriljce. Gneisi su po sastavu posebno slični granitima. Tlo koje se formira na takvim stijenama ima slične osobine kao i tla na kiselim magmatskim stijenama.
Hlor.
1. Položaj aluminijuma u tabeli DI Mendeleev. Struktura atoma, manifestuje se stepen oksidacije.
Hlor - element glavne podgrupe VII grupe, treći period, sa atomskim brojem 17. Označava se simbolom Cl (lat. Chlorum). Hemijski aktivan nemetalni . Uključeno u halogenu grupu .
Jednostavna supstanca hlor u normalnim uslovima - otrovni plin žućkasto-zelene boje teži je od zraka, sa jakim mirisom . Dvoatomski molekul klora (formula Cl 2).
Glavno stanje: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-element. Art. -1 +1 +3 +5 +7.
Struktura elektronske ljuske.
Na nivou valencije sadrži atom hlora 1 nepareni elektron : 1s 2 2s 2 2p 6 3s 2 3p 5, tako da je valencija od 1 za atom hlora vrlo stabilna. Zbog prisustva u atomu hlora nenastanjenih orbitala d-sub-nivoa, atom hlora može pokazivati i druge stepene oksidacije. Shema formiranja pobuđenih stanja atoma:
Poznata su i jedinjenja hlora u kojima atom hlora formalno pokazuje valenciju 4 i 6, na primer ClO 2 i Cl 2 O 6. Međutim, ova jedinjenja su radikali, odnosno imaju jedan nespareni elektron.
2. Fizička svojstva.
U normalnim uslovima, hlor je žuto-zeleni gas sa zagušljivim mirisom. Neke od njegovih fizičkih svojstava su prikazane u nastavku.
Gustina: 3.214 g / l, tečnost - na -35 ° C - 1.557, TV. na -105 0- 1,9 g / cm3.
Tačka topljenja: 172.2 K
Tačka ključanja: 238.6 K
Toplina fuzije: 6.41 kJ / mol
Toplina isparavanja: 20.41 kJ / mol.
Gas klora je relativno lako rastopiti. Počevši od pritiska od 0,8 MPa (8 atmosfera), hlor će već biti na sobnoj temperaturi. Kada se ohladi na temperaturu od -34 ° C, hlor postaje i tečnost pri normalnom atmosferskom pritisku. Tečni hlor je žuto-zelena tečnost sa veoma visokim korozivnim efektom (zbog visoke koncentracije molekula). Povećanjem pritiska možete postići postojanje tečnog hlora do temperature +144 ° C (kritična temperatura) pri kritičnom pritisku od 7,6 MPa. U pogledu električne provodljivosti, tečni hlor se odvija među najjačim izolatorima: provodi struju skoro milijardu puta lošije od destilovane vode, a 10 22 puta lošiju od srebra. Brzina zvuka u hloru je oko jedan i po puta manja nego u vazduhu.
3. Biti u prirodi.
U prirodi postoje dva izotopa hlora 35 Cl i 37 Cl. Hlor je najčešći halogen u zemljinoj kori. . Hlor je veoma aktivan - direktno se povezuje sa skoro svim elementima periodičnog sistema. Dakle, u prirodi se nalazi samo u obliku spojeva u sastavu minerala:
ü halite NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
ü bischofite MgCl 2 · 6H 2 O,
ü karnalit KCl · MgCl 2 · 6H 2 O,
ü Cainite KCl · MgSO 4 · 3H 2 O.
Najveće rezerve hlora sadržane su u solima, vodama, morima i okeanima (sadržaj u morskoj vodi je 19 g / l). Klor čini 0,024% ukupnog broja atoma u zemljinoj kori; broj klarka (brojevi koji izražavaju prosječan sadržaj kemijskih elemenata u zemljinoj kori, hidrosferi, Zemlji, svemirskim tijelima, geokemijskim ili kosmokemijskim sistemima, itd., u odnosu na ukupnu masu ovog sistema. Izražava se u% ili g / kg.) hlor - 0.017%. Ljudsko telo sadrži 0,25% jona hlora po težini. Kod ljudi i životinja, hlor se nalazi uglavnom u međućelijskim tekućinama (uključujući krv) i igra važnu ulogu u regulaciji osmotskih procesa, kao iu procesima vezanim za rad nervnih ćelija.
4. Hemijska svojstva klora i njegovih spojeva. Dobijam hlor.
Struktura atoma silicija. Si. +14. Uzbuđeno stanje. E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
Slika 3 prezentacije "Silicij" na časove hemije na temu "silikon"Dimenzije: 960 x 720 piksela, format: jpg. Za preuzimanje besplatne slike za sat hemije, kliknite desnom tipkom miša na sliku i kliknite na "Spremi sliku kao ...". Da biste prikazali slike u lekciji, možete preuzeti i besplatnu prezentaciju "Silicon.ppt" sa svim slikama u zip-arhivi. Veličina arhive - 562 KB.
Preuzmite prezentacijuSilicon
"Silicijum i njegova jedinjenja" - Struktura i svojstva atoma. Semiconductor. t rastopiti (Si) = 1415 ° C, t rastopiti (dijamant) = 3730 ° C. Getting silicon. Otkriće silikona. Uključeno je iu sastav biljaka i životinja. Fizička svojstva silicija. Dakle, cigla je keramika, a pločice i fragmenti antičke grčke amfore su i keramika. Ciljevi: Kemijska svojstva silicija.
"Silikonski spojevi" - Silicijum i njegova jedinjenja. Kemijska svojstva SiO2. Silane Dobija se silicijumska kiselina. Silikonska svojstva. Silicijum oksid. Prirodni silikati. Stanje oksidacije Rhinestone Topaz. Dobijanje silikona u laboratoriji. Biti u prirodi. Kristalne rešetke. Otkriće silikona. Ametist. Getting silicon.
"Izotopi silicija" - Odvajanje izotopa silicija. Proizvodnja polikristalnog silicija. Izgledi za upotrebu monoizotopnog silikona. Izotopsko razrjeđivanje kada se uzgaja jedan kristal iz kvarcnog lonca. Proizvodnja semena kristala. Zavisnost položaja maksimuma Ramanove trake od atomske mase.
"Silikonska lekcija" - Koji od najvažnijih hemijskih elemenata u živoj i neživoj prirodi? Oksidi ugljika i silicija. Supstanca je transparentna. O manifestaciji nemetalnih i metalnih svojstava. Sumiranje refleksije. Završno testiranje. Oksidi ugljika i silicijevih hidroksida? Stanje agregacije: a) tekuće, b) plin, c) čvrsto.
"Silicijum" - Silicijum je jednostavna supstanca. Fizička svojstva. Silicijum oksid (IV). Silicides Znači za žive organizme. Interakcija sa metalima. Interakcija sa nemetalima. Silicon carbide. Silicij u prirodi. Silicon. Proizvodi silikatne industrije. Jedan od tipova prirodnih silicijumskih jedinjenja je silikat.
"Ugljik i silicij" - oksid silicija (IV). Elementi IV grupe glavne podgrupe. Toksičnost. 7. Zanimljivo za ugljik. Silikati. Povucite na dodir. Dijamant je najteža prirodna supstanca. Hemijska svojstva Više od 99% ugljika u atmosferi je u obliku ugljičnog dioksida. Carbides. 6. Aplikacija. Jedan od najmekših među čvrstim materijama.
Ukupno ima 6 prezentacija.
