Genetyczne szeregi przykładów niemetali. Związek genetyczny między klasami substancji - hipermarkcja wiedzy
Istnieje związek genetyczny między prostymi substancjami, tlenkami, zasadami, kwasami i solami, a mianowicie możliwością ich wzajemnego przejścia (przemiany).
Na przykład prosta substancja - wapń w wyniku oddziaływania z tlenem zamienia się w tlenek: 2Ca + O 2 = 2CaO.
Tlenek wapnia w kontakcie z wodą tworzy wodorotlenek wapnia CaO + H2O = Ca (OH) 2, a ten ostatni, wchodząc w interakcje z kwasem, przekształca się w sól: Ca (OH) 2 + H2SO4 = CaSO 4 + 2H 2 O.
Transformacje te można przedstawić za pomocą schematu:
Ca → CaO → Ca (OH) 2 → CaSO 4
Podobny schemat można zapisać dla niemetali, na przykład siarki:
S → SO 3 → H 2 SO 4 → CaSO 4
Tak więc tę samą sól otrzymuje się na różne sposoby.
Możliwe jest również odwrotne przejście od soli do innych klas związków nieorganicznych i prostych substancji:
CuSO 4 → Cu (OH) 2 → CuO → Cu
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4
Cu (OH) 2 = CuO + H20
CuO + H 2 = Cu + H 2 O (redukcja miedzi)
Podobna zależność między klasami związków nieorganicznych, oparta na wytwarzaniu substancji jednej klasy z substancji drugiej, nazywana jest genetyczną.
Właściwości związków kompleksowych znajdują odzwierciedlenie w schemacie genetycznym głównych klas związków nieorganicznych (patrz rysunek). Odzwierciedla etapy rozwoju materii nieorganicznej wzdłuż dwóch głównych linii, od typowych metali do typowych niemetali o przeciwnych właściwościach.
Metale, których właściwością chemiczną atomu jest zdolność do oddawania elektronów i niemetali, których główną właściwością chemiczną jest zdolność ich atomów do przyłączania elektronów przeciwnych do siebie we właściwościach. Wraz z komplikowaniem składu substancji nadal pojawiają się te przeciwstawne tendencje.
Typowe metale i pierwiastki przejściowe w najniższym stopniu utlenienia tworzą podstawowe tlenki, podczas gdy typowe niemetale i pierwiastki przejściowe w stanie wysokiego utleniania tworzą przeciwne tlenki kwasowe.
Proste substancje
Amfoteryczne
Niemetale
Podstawowe tlenki
Amfoteryczne
Kwasowy
Podstawy
Amfoteryczne
wodorotlenki
Schemat genetyczny głównych klas związków nieorganicznych
Przy dalszym komplikowaniu składu substancji powstają wodorotlenki, tlenki zasad odpowiadające zasadom i tlenki kwasów odpowiadające kwasowi. Zasady przeciwne właściwościom i kwasowi aktywnie reagują ze sobą tworząc sole. Interakcja przeciwieństw jest siłą napędową reakcji. Dlatego też zasadowe i kwasowe tlenki, zasady i kwasy aktywnie współdziałają ze sobą, a dwa kwaśne tlenki lub dwa podstawowe tlenki nie oddziałują ze sobą, ponieważ ich właściwości są bliskie.
Tak więc właściwości złożonego związku są określane na podstawie właściwości jego elementów składowych. Główne prawa zmiany tych właściwości podsumowano w następujących zgłoszeniach (tabela 6).
1. W okresach, w których następuje wzrost liczby porządkowej, właściwości pierwiastków zmieniają się z metalicznych w niemetaliczne. Zwiększa się liczba elektronów na poziomie zewnętrznym, wzrasta stopień utleniania pierwiastka, zmniejsza się promień atomu i jonu, energia jonizacji i powinowactwo do wzrostu elektronów. Zgodnie z tym wzrastają podstawowe spadki i kwaśne właściwości tlenków i wodorotlenków.
2. W głównych podgrupach podstawowe właściwości tlenków i wodorotlenków rosną wraz ze wzrostem liczby atomowej. W przypadku elementów grup bocznych ze zwiększeniem liczby sekwencji, charakterystyczna jest bardziej złożona zmiana właściwości. Po pierwsze, właściwości metaliczne są ulepszane, a następnie zmniejszane.
3. Aktywne metale odpowiadają tlenkom i wodorotlenkom z silnie zaznaczonymi podstawowymi właściwościami. Najbardziej aktywnymi metalami są alkalia i ziemie alkaliczne. Tworzą rozpuszczalne w wodzie tlenki i silne rozpuszczalne zasady - alkalia.
4. Metale o małej aktywności (wszystkie oprócz zasad i metali ziem alkalicznych) tworzą słabe zasady trudne do rozpuszczenia w wodzie:
Cu (OH) 2, Fe (OH) 3.
5. Tlenki i wodorotlenki o silnie wyraźnych właściwościach kwasowych odpowiadają aktywnym niemetalom.
6. Metale amfoteryczne tworzą amfoteryczne tlenki i wodorotlenki.
7. Jeśli pierwiastek wykazuje różne stopnie utlenienia, odpowiadają mu tlenki i wodorotlenki o różnych właściwościach.
Temat: GENETYCZNE POŁĄCZENIE MIĘDZY metalami i niemetalami i ich związkami. 9 stopień
Cele: edukacyjny: skonsolidować koncepcję "serii genetycznej", "połączenia genetycznego"; nauczyć, jak tworzyć serie elementów genetycznych (metali i niemetali), aby uzupełnić równania reakcji odpowiadające serii genetycznej; sprawdź, jak się uczy się wiedzy właściwości chemiczne tlenki, kwasy, sole, zasady, rozwijanie: rozwijanie umiejętności analizy, porównywania, podsumowywania i wyciągania wniosków, uzupełnianie równań reakcji chemicznych; edukacyjny: promowanie tworzenia światopoglądu naukowego.
Zapewnienie klas: tabele "System okresowy", "Tabela rozpuszczalności", "Metals Activity Series", instrukcje dla studentów, zadania do testowania wiedzy.
Postęp: 1) Org. chwila
2) Sprawdź d / s
3) Przestudiuj nowy materiał
4) Mocowanie
5) D / C
1) Org. chwila. Pozdrowienia
2) Sprawdź d / s.
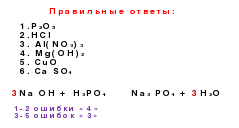
Połączenia genetyczne są połączeniami między różnymi klasami na podstawie ich interkonwersji.
Znając klasy substancji nieorganicznych, możliwe jest tworzenie serii genetycznej metali i niemetali. Podstawą tych serii jest ten sam element.
Wśród metali występują dwa typy rzędów:
1
. Genetyczna seria, w której alkalia działają jako baza. Ta seria może być reprezentowana przy użyciu następujących przekształceń:metal → podstawowy tlenek → alkalia → sól
Na przykład K → K
2 O → KOH → KCl2
. Seria genetyczna, w której podstawa jest nierozpuszczalną podstawą, wtedy seria może być przedstawiona jako łańcuch przekształceń:metal → tlenek zasady → sól → nierozpuszczalna baza →
→podstawowy tlenek → metal
Na przykład Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu
1
. Genetyczna seria niemetali, w której rozpuszczalny kwas działa jako ogniwo w serii. Łańcuch przekształceń można przedstawić w następujący sposób:niemetalowy → kwasowy tlenek → rozpuszczalny kwas → sól
Na przykład P → P
2 O 5 → H 3 PO 4 → Na 3 PO 42
. Genetyczna seria niemetali, w której nierozpuszczalny kwas działa jako ogniwo w serii:niemetalowy → kwasowy tlenek → sól → kwas →
→tlenek kwasowy → niemetalowy
Na przykład
Si→ Sio 2 → Na 2 Sio 3 → H 2 Sio 3 → Sio 2 → Si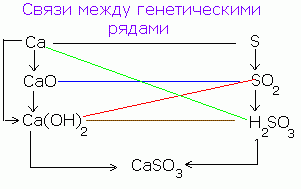
Frontalna rozmowa na temat:
Co to jest powiązanie genetyczne? Połączenia genetyczne są połączeniami między różnymi klasami w oparciu o ich wzajemne konwersje Co to jest seria genetyczna?
Seria genetyczna - seria substancji - przedstawicieli różnych klas, które są związkami jednego pierwiastka chemicznego, połączonymi wzajemnie przemianami i odzwierciedlającymi przemiany tych substancji. Podstawą tych serii jest ten sam element.
Jakie typy serii genetycznych można wyróżnić? Wśród metali wyróżnić można dwa typy serii:
a) Seria genetyczna, w której alkalia działają jako baza. Ta seria może być reprezentowana przy użyciu następujących przekształceń:
metal → podstawowy tlenek → alkalia → sól
na przykład genetyczna seria potasu K → K
2 O → KOH → KClb) Szereg genetyczny, w którym podstawa jest nierozpuszczalną zasadą, wówczas serie mogą być reprezentowane jako łańcuch przekształceń:
metal → tlenek zasady → sól → baza nierozpuszczalna → tlenek zasadowy → metal
na przykład: Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → CuWśród niemetali można również rozróżnić dwa typy rzędów:
a) Genetyczne serie niemetali, w których rozpuszczalny kwas działa jako ogniwo w serii. Łańcuch przekształceń można przedstawić następująco: niemetalowy → kwasowy tlenek → rozpuszczalny kwas → sól.
Na przykład: P → P
2 O 5 → H 3 PO 4 → Na 3 PO 4b) Genetyczny rząd niemetali, gdzie nierozpuszczalny kwas: niemetalowy → kwasowy tlenek → sól → kwasowy → kwasowy tlenek → niemetalowy działa jako ogniwo w serii
Na przykład: Si → SiO
2 → Na 2 Sio 3 → H 2 Sio 3 → SiO 2 → SiRealizacja zadań dla opcji:
1. Wybierz formuły tlenkowe w swojej wersji, wyjaśnij swój wybór, w oparciu o znajomość charakterystyki składu tej klasy związków. Zadzwoń do nich.
2. W kolumnie z formułą swojego wariantu znajdź formuły kwasowe i wyjaśnij swój wybór na podstawie analizy składu tych związków.
3. Określić wartościowości reszt kwasowych w kompozycji kwasowej.
4. Wybierz formuły soli i nazwij je.
5. Uzupełnij formuły soli, które można utworzyć za pomocą magnezu i kwasów w twoim wariancie. Zapisz je, nazwij.
6. W kolumnie z formułą swojej odmiany znajdź podstawowe formuły i wyjaśnij swój wybór na podstawie analizy składu tych związków.
7. W swoim wariancie wybierz wzory substancji, za pomocą których może reagować roztwór kwasu ortofosforowego (chlorowodorowego, siarkowego). Dokonaj odpowiednich równań reakcji.
9. Wśród formuł Twojej opcji wybierz formuły substancji, które mogą ze sobą współdziałać. Dokonaj odpowiednich równań reakcji.
10. Wykonaj łańcuch genetycznych wiązań związków nieorganicznych, który będzie zawierał substancję, której wzór podany jest w Twojej wersji pod numerem jeden.
Opcja 1
Opcja 2
Cao
Hno
3Fe (OH)
3N
2 OZn (NO
3 ) 2Cr (OH)
3H
2 SO 3H
2 SPbo
LiOH
Ag
3 PO 4P
2 O 5NaOH
Zno
CO
2BaCl
2HCl
H
2 CO 3H
2 SO 4Cuso
4Z tych substancji utworzyć linię genetyczną, używając wszystkich formuł. Napisz równania reakcji, dzięki którym możesz wykonać ten łańcuch przekształceń:
I opcja: ZnSO
4, Zn, ZnO, Zn, Zn (OH) 2 : II opcja:Na 2 SO 4, NaOH, Na, Na 2 O 2 , Na 2 O4) Mocowanie1.
Al→ Al 2 O 3 → AlCl 3 → Al( OH) 3 → Al 2 O 32.
P→ P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 23. Zn → ZnCl
2 → Zn (OH) 2 → ZnO → Zn (NO 3 ) 24. Cu → CuO → CuCl
2 → Cu (OH) 2 → CuO → Cu5.N
2 O 5 → HNO 3 → Fe (NIE 3 ) 2 → Fe (OH) 2 → FeS → FeSO 45) Praca domowa:
wykreślić stopniowe przejście z wapnia do węglanu wapnia i przygotować raport na temat stosowania jakiejkolwiek soli w medycynie (z wykorzystaniem dodatkowej literatury).

Wśród metali wyróżnić można dwa typy rzędów: 1. Szeregi genetyczne, w których alkalia działają jako baza. Ta seria może być reprezentowana przez następujące transformacje: metal - tlenek zasadowy - sól alkaliczna, na przykład, seria genetyczna potasu K - K 2 O - KOH - KCl.

2. Szereg genetyczny, w którym nierozpuszczalna zasada działa jako baza, wówczas szeregi można przedstawić jako łańcuch przekształceń: metal - podstawowy tlenek - nierozpuszczalna sól - podstawowy tlenek - metal. Cu-- CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e Gen genetyczna miedzi "\u003e Cu jest genetyczną serią miedzi"\u003e "title =" (! LANG: 2. Seria genetyczna, w której podstawa jest nierozpuszczalną zasadą, wtedy seria może być przedstawiona jako łańcuch przekształceń: metal - tlenek zasadowy - sól - nierozpuszczalna baza-- głównym tlenkiem jest metal, Cu- CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> title="2. Szereg genetyczny, w którym nierozpuszczalna zasada działa jako baza, wówczas szeregi można przedstawić jako łańcuch przekształceń: metal - podstawowy tlenek - nierozpuszczalna sól - podstawowy tlenek - metal. Cu-- CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> !}
Wśród niemetali można również wyróżnić dwa typy rzędów: 1. Genetyczne szeregi niemetali, w których rozpuszczalny kwas działa jako ogniwo w szeregu. Łańcuch przekształceń może być przedstawiony w następujący sposób: niemetal - kwas tlenowy - rozpuszczalny kwas - -sol. P-- P 2 O 5 - H 3 PO 4 - Na 3 PO 4. Fosforowy zakres genów

Istnieje związek genetyczny między klasami związków nieorganicznych. Z prostych substancji można uzyskać kompleksowość i odwrotnie. Ze związków jednej klasy można uzyskać związki innej klasy.
Uproszczony związek genetyczny między klasami związków nieorganicznych można przedstawić za pomocą następującego schematu:
Kolejność takich przekształceń dla niemetali można przedstawić za pomocą następującego schematu: CANPO 4
→ 2 2 О 5 Р 3 О 4 3 Р (О 4) 2
(Saon) 3 PO 4
W przypadku typowych metali można wykonać następujący łańcuch przekształceń:
Ba → BaO → Ba (OH) 2 → BaSO 4
W przypadku metali, których tlenki i wodorotlenki są amfoteryczne (półmetale), można przeprowadzić następujące przekształcenia:
Al ^ Al2O3 ^ Al (OH) 3 ^ Na ^ AlCl3 ^ AlOHCl2 ^ Al (OH) 3 ^ Al203.
Połączenia między klasami:
1. Metale niemetalowe→ sól.
Przy bezpośredniej interakcji metali i niemetali powstają sole kwasów beztlenowych (halogenków, siarczków):
2Na + C1 2 = 2NaCl
Związki te są stabilne i nie rozkładają się podczas ogrzewania.
2. Podstawowe tlenki, kwaśne tlenki→ sól.
CaO + CO 2 = CaCO3;
Na 2 O + SO 3 = Na 2 SO 4.
3. Podstawy, kwasy→ sól.
Realizuje się go w reakcji neutralizacji:
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O,
HE - + H + → H 2 O;
Mg (OH) 2 + 2HC1 = MgCl2 + 2H 2 O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H 2 O.
4. Metale→ podstawowe tlenki.
Większość metali oddziałuje z tlenem, tworząc tlenki:
2Ca + O2 = 2CaO;
4A1 + 3O 2 = 2A1 2 O 3.
Złoto, srebro, platyna i inne metale szlachetne nie oddziałują z tlenem, tlenki takich metali są uzyskiwane pośrednio.
5. Niemetale→ tlenki kwasów.
Niemetale (z wyjątkiem halogenów i gazów szlachetnych) oddziałują z tlenem, tworząc tlenki:
4P + 5O 2 = 2P 2O 5;
S + O2 = SO2.
6. Podstawowe tlenki→ tereny.
Bezpośrednią interakcję z wodą można uzyskać tylko z wodorotlenkami metali alkalicznych i ziem alkalicznych (alkaliami):
Na 2 O + H20 = 2NaOH;
CaO + H20 = Ca (OH) 2.
Pozostałe tereny uzyskuje się pośrednio.
7. Tlenki kwasowe→ kwas.
Tlenki kwasów reagują z wodą, tworząc odpowiednie kwasy:
SO3 + H20 = H2SO4;
2 2 O 5 + 3 H 2 O = 2 H 3 PO 4.
Wyjątkiem jest SiO 2, który nie reaguje z wodą.
8. Podstawy, kwaśne tlenki→ sól.
Alkalis oddziałuje z kwasowymi tlenkami, tworząc sole:
2NaOH + SO 3 = Na 2 SO 4 + H 2 O,
2OH - + SO 3 = SO 4 2 2 + H 2 O;
Ca (OH) 2 + СO 2 = CaCO 3 ↓ + Н 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. Kwasy, podstawowe tlenki→ sól.
Tlenki metali rozpuszczają się w kwasach tworząc sole:
CuO + H 2 SO 4 = CuSO 4 + H 2 O,
CuO + 2H + = Cu 2+ + H20;
Na 2 O + 2HS1 = 2NaCl + H 2 O,
Na 2 O + 2H + = 2Na + + H2O.
10. Podstawy→ podstawowe tlenki.
Nierozpuszczalne zasady i LiOH rozkładają się po ogrzaniu:
2LiOH = Li2O + H20;
Cu (OH) 2 = CuO + H20.
11. Kwasy→ tlenki kwasów.
Niestabilne kwasy zawierające tlen rozkładają się po ogrzaniu (H 2 SiO 3), a nawet bez ogrzewania (H 2 CO 3, HClO). Jednocześnie wiele kwasów jest odpornych na ogrzewanie (H 2 SO 4, H 3 PO 4).
H 2 SiO 3 = H20 + SiO2;
H 2 CO 3 = H 2 O + CO 2.
12. Tlenki metali→ metale.
Niektóre tlenki metali ciężkich mogą rozkładać się na metal i tlen:
2HgO = 2Hg + O 2.
Ponadto metale otrzymuje się z odpowiednich tlenków za pomocą środków redukujących:
3Mn02 + 4Al = 3Mn + 2Al2O3;
Fe 2 O 3 + 3H 2 = 2 Fe + 3H 2 O.
13. Tlenki kwasowe→ niemetale
Większość tlenków niemetali nie rozkłada się po podgrzaniu. Niemetal i tlen rozkładają tylko niektóre niestabilne tlenki (tlenki halogenu).
Niektóre niemetale otrzymuje się przez redukcję z odpowiednich tlenków:
SiO 2 + 2Mg = 2MgO + Si.
14. Sole, zasady → zasady.
Nierozpuszczalne zasady otrzymuje się przez działanie alkaliów na roztwory odpowiednich kwasów:
CuSO 4 + 2NaOH = Cu (OH) 2 ↓ + Na 2 SO 4,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl 2 + 2KOH = Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - = Fe (OH) 2 ↓.
15. Sole, kwasy → kwasy.
Rozpuszczalne sole reagują z kwasami (zgodnie z serią ciśnień), jeśli wynikiem jest słabszy lub lotny kwas:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓,
SiO 3 2 + 2 H + → H 2 SiO 3 ↓;
NaCl (s.) + H2SO4 (k) = NaHS04 + HC1.
16. Sole→ podstawowe tlenki, kwaśne tlenki.
Sole niektórych kwasów zawierających tlen (azotany, węglany) rozkładają się po ogrzaniu:
CaCO3 = CaO + CO2;
2Cu (NO 3) 2 = 2CuO + 4NO 2 + O 2.
ĆWICZENIA NA NIEZALEŻNĄ PRACĘ NA TEMAT "GENETYCZNE PODŁĄCZENIE MIĘDZY KLASAMI ZWIĄZKÓW NIEORGANICZNYCH"
1. Wymień wymienione poniżej substancje, rozprowadź je na klasy związków nieorganicznych: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O7, Fe (OH) 2, P 2 O 5, HF, MnO 2.
2. Z substancji wymienionych poniżej możliwe jest uzyskanie wodorotlenku (kwasu lub zasady) w jednym etapie: miedź, tlenek żelaza (P), tlenek baru, tlenek azotu (P), tlenek azotu (V), tlenek krzemu, siarczan miedzi, chlorek potasu , potas, węglan magnezu.
3. Na powyższej liście wpisz wzory substancji związanych z: 1) tlenkami; 2) tereny; 3) kwasy; 4) sole:
C02, NaOH, HC1, SO3, CUSO4, NaN03, KC1, H2SO4, Ca (OH) 2, P205, HN03, Al (OH) 3.
4. Nazwać substancje: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlOH) 3 (PO 4) 2, Ba (MnO 4 ) 2, CO, HI. Wskaż klasę, do której należy każda substancja.
5. Zapisz wzory cząsteczek następujących substancji i wskaż klasę, do której należy każda substancja:
1) wodorowęglan miedzi (II);
2) tlenek azotu (V);
3) wodorotlenek niklu (II);
4) wodorofosforan baru;
5) kwas nadchlorowy;
6) wodorotlenek chromu (III);
7) chloran potasu;
8) kwas siarkowodorowy;
9) cynamonian sodu.
6. Podaj przykłady reakcji połączenia między:
1) proste substancje - niemetale;
2) prosta substancja i tlenek;
3) tlenki;
4) złożone substancje, które nie są tlenkami;
5) metal i niemetal;
6) trzy substancje.
7. Która z poniższych substancji może reagować:
1) tlenek węgla (IV): HCl, O2, NO2, KOH, H20;
2) tlenek magnezu: Ba (OH) 2, HCl, CO2, O2, HNO 3;
3) wodorotlenek żelaza (II): KCl, HCl, KOH, O2, H20, HNO3;
4) chlorowodór: Zn, MgO, ZnCl2, HNO 3, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Czy możliwe jest oddziaływanie między następującymi substancjami?
1) tlenek węgla (IV) i wodorotlenek potasu;
2) wodorosiarczan potasu i wodorotlenek wapnia;
3) fosforan wapnia i kwas siarkowy;
4) wodorotlenek wapnia i tlenek siarki (IV);
5) kwas siarkowy i wodorotlenek potasu;
6) wodorowęglan wapnia i kwas fosforowy;
7) krzemionka i kwas siarkowy;
8) tlenek cynku i tlenek fosforu (V).
Napisz równania możliwych reakcji, określ warunki ich występowania. Jeśli reakcje mogą prowadzić do różnych substancji, wówczas należy wskazać, jaka jest różnica w warunkach ich realizacji.
9. Podaj równania reakcji dla uzyskania następujących substancji: ortofosforan sodu (4 sposoby), siarczan potasu (7 sposobów), wodorotlenek cynku.
10. Jedną z metod wytwarzania sody (węglanu sodu) jest działanie wody i tlenku węgla (IV) na glinian sodu. Uzupełnij równania reakcji.
11. Zmieniając współczynniki, napisz produkty reakcji:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2O 5 + 2Al (OH) 3 →
4) P 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12. Zrób równania reakcji na otrzymywanie różnych rodzajów soli:
1) SO 2 + Ba (OH) 2 → (sole średnie i kwaśne),
2) A1 2 O 3 + H 2 O + HNO 3 → (średnia sól, sole zasadowe),
3) Na 2 O + H 2 S → (sole średnie i kwaśne),
4) SO 3 + Sa (OH) 2 → (sole średnie i zasadowe),
5) CaO + H20 + P205 → (sól podstawowa, sole kwasowe).
13. Wypełnij równania reakcji:
CaO + Al 2O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca (HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaS04 + H 2 SO 4 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO 3 → Bi (OH) 3 + H 2 SO 4 (niewystarczające) →
AlCl 3 + NaOH (niedobór) → (FeOH) Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (nadmiar) →
AlC1 3 + NaOH (nadmiar) → Ca (AlO2) 2 + HCl (nadmiar) →
14. Zapisz równania reakcji, dzięki którym możesz przeprowadzić następujące transformacje:
1) Cu → CuO → CuSO 4 → Cu (OH) 2 → CuC1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) → 2 2 O 5 3 О 4 К 4 К 3 О 4 3 Р 3 Р 3 3 О 4
4) Mg → MgO → MgCl2 → Mg (OH) 2 → Mg (HSO 4) 2 → MgSO4
5) Ca → CaO → Ca (OH) 2 → CaCO3 → Ca (HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaСrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
9) Al-Al2O3\u003e Al2 (S04) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → S02 → S03 → NaHS04 → Na2S04 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn (OH) 2 → Na 2 → Zn (NO 3) 2
13) Ca → CaCl2 → CaCO3 → Ca (HCO3) 2 → Ca (NO 3) 2
14) Ca → Ca (OH) 2 → CaCO3 → CaCl2 → CaCO3 → Ca (NO 3) 2
15) CuO → CuCl2 → Cu (NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO4 → MgCl2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl3 → Al (N 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl2 → Ca → Ca (OH) 2 → CaCl2 → Ca (NO 3) 2 → CaSO 4
31) Cu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgS04 → MgCl2 → MgOHCl → Mg (OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (N 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn (OH) 2 → ZnCl 2 → AlCl 3 → Al (OH) 3 → A1 2 O 3
36) CuCl2 → Cu (OH) 2 → CuSO 4 → ZnSO 4 → Zn (OH) 2 → Na 2 ZnO 2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl 3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgSO 4 → MgCl 2 → Mg (NO 3) 2 → Mg (OH) 2 → MgO
40) siarczan glinu → chlorek aluminium → azotan aluminium → tlenek glinu → glinian potasu → wodorotlenek glinu → wodorotlenek glinu → chlorek glinu.
41) Na → NaOH → Na3P04 → NaN03 → HN03 → N2O5
42) BaCO3 → Ba (HCO3) 2 → BaCO3 → (BaOH) 2CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) bar → wodorotlenek baru → wodorowęglan baru → chlorek baru → węglan baru → chlorek baru → wodorotlenek baru
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr (OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr (OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → S 2 → S → ZnS → ZnO → ZnCl 2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2
51) С → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO 3) 2 → CuO → Cu
54) 2 2 O 5 → Н 3 О 4 → СаНРО 4 → Са (Н 2 РО 4) 2 → Са 3 (О 4) 2
55) Fe → FeCl2 → Fe (OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu (NO 3) 2
59) KHSO 3 → CaSO 3 → Ca (HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO3 → Na2CO3 → NaCl → NaHS04 → Na2S04
62) K → KOH → KCI → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na2SO4 → NaCl
64) Al ^ AlCl3 ^ Al (OH) 3 ^ Al2O3 ^ Al (OH) 3
65) CuO → Cu → CuCl2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl2 → Fe (NO 3) 2 → Fe
68) Fe (NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe (NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu (OH) 2 → CuO → Cu
70) MgCO3 → MgO → MgCl2 → Mg (OH) 2 → Mg (NO 3) 2
71) Mg → Mg (OH) 2 → MgS04 → MgCO3 → Mg (HCO3) 2
72) CaO → Ca (OH) 2 → CaCl2 → CaCO 3 → CO 2
73) CaCO3 → Ca (HCO3) 2 → CaCl2 → Ca (NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe (OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KS1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO 4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu (NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → S02 → Na 2 SO 4 → NaOH
80) Al-Al (OH) 3 → Al2 (S04) 3 → Al2O3 → Al (OH) 3
81) CaCl2 → CaCO3 → Ca (HCO3) 2 → CaCO3 → CaSiO3
82) S → ZnS → H 2 S → Ca (HSO 3) 2 → SO 2
83) Na2S04 → NaCl → HCl → CaCl2 → Ca (NO 3) 2
84) Na2S03 → S02 → H 2SO 4 → HCI → FeCl2
85) С → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca (H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → Al 2 O 3 → Al (OH) 3 → A1C1 3 → A1 (NIE 3) 3
88) HCl → CuCl2 → Cl2 → HCl → H 2
89) P205 → Na2HPO4 → Na3P04 → Ca3 (PO4) 2 → CaS04
90) NH3 → NH4Cl → NH3 ∙ H20 → NH4HC03 → NH3
91) NH4Cl → KCI1 → HCl → CuCl2 → Cu (OH) 2
92) NH3 → NH4H2PO4 → (NH4) 2HP04 → NH3 → NH4NO3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca (HCO 3) 2
94) Na → NaOH → NaHC03 → Na2S04 → NaOH
95) KNO 3 → K 2 SO 4 → KC 1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu (OH) 2 → CuSO 4 → Cu (OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe (OH) 3 → Fe (NO 3) 3 → Fe 2 O 3
100) Al → Al 2 O 3 → Al (N 3) 3 → Al 2 O 3 → Al (OH) 3
101) CaO → CaCO3 → CaSiO 3 → Ca (NO 3) 2 → O 2
102) Cu → Cu (OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → S02 → ZnS04 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe (OH) 3 → Fe (NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn (NO 3) 2
108) ZnO → ZnSO 4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO3 → Na2CO3 → Na3P04 → NaH2PO4 → Ca3 (PO4) 2
111) CaCl2 → CaSO3 → Ca (OH) 2 → CaCl2 → Ca (NO 3) 2
112) NaOH → Na2CO3 → NaHS04 → NaN03 → NaHS04
113) Na2SiO3 → Na2C03 → Na2S04 → NaCl → Na2S04
114) KNO 3 → KHSO4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl2 → Cu (NO 3) 2 → NO 2 → HNO 3
117) Ca (NO 3) 2 → O 2 → SiO2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca (H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu (NO 3) 2 → CuO → Cu (OH) 2
123) Al → Al 2 O 3 → Al (OH) 3 → Al 2 (SO 4) 3 → Al (nr 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO3) 2 → CaO → CaCl2
125) NH 3 ∙ H 2 O → NH 4 Cl → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca (HSO 3) 2 → CaCl 2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 ∙ H 2 O → NH 4HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl3 → Fe (NO 3) 3 → Fe
131) Zn → Zn (OH) 2 → Na 2 → Zn (OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn (OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnS04 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al-K3 → Al (OH) 3 → Na 3 → AlCl3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → Al 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NR 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlC\u003e 2 → Al 2 O 3
140) Be → Na2 → Be (OH) 2 → Na 2 BeO2 → BaBeO 2
DOŚWIADCZENIA DOŚWIADCZALNE W TEMATIE "PODSTAWOWE ZAJĘCIA ZWIĄZKÓW NIEORGANICZNYCH"
DOŚWIADCZENIE 1.Reakcje neutralizacji.
a) Oddziaływanie mocnego kwasu i silnej zasady.
Wlać 5 ml 2N roztworu kwasu chlorowodorowego do naczynia porcelanowego i dodać kroplami 2 n roztworu wodorotlenku sodu. Wymieszaj roztwór szklanym prętem i sprawdź jego działanie na papierosie, przenosząc kroplę roztworu na badanie lakmusowe. Konieczne jest uzyskanie neutralnej reakcji (niebieski i czerwony papier lakmusowy nie zmienia koloru). Odparować uzyskany roztwór do sucha. Co zostało utworzone? Napisz równania reakcji molekularnej i jonowej.
b) Interakcja słabego kwasu i silnej zasady.
Wlać do probówki 2 ml roztworu alkalicznego 2N i dodać roztwór kwasu octowego, aż roztwór stanie się neutralny. Napisz równania reakcji molekularnej i jonowej. Wyjaśnij, dlaczego równowagowa reakcja jonowa, w której bierze udział słaby elektrolit (kwas octowy), przesuwa się w kierunku tworzenia cząsteczek wody.
DOŚWIADCZENIE 2. Amfoteryczne wodorotlenki.
Z odczynników dostępnych w laboratorium uzyskać osad wodorotlenku cynku. Wstrząśnij uzyskanym osadem i wlej jego niewielkie ilości do 2 probówek. W jednej z probówek dodać roztwór kwasu chlorowodorowego, w drugim - roztwór wodorotlenku sodu (nadmiar). Co zaobserwowano? Napisz równania odpowiednich reakcji w postaci molekularnej i jonowej.
DOŚWIADCZENIE 3.Właściwości chemiczne soli.
a) Oddziaływanie roztworów soli z tworzeniem trudno rozpuszczalnej substancji.
Wlać 2 ml roztworu węglanu sodu do probówki i dodać roztwór chlorku baru aż do pojawienia się białego osadu. Napisz równanie reakcji chemicznej w postaci jonowej i molekularnej. Osad dzieli się na dwie części. Wlać roztwór kwasu siarkowego do jednej z probówek, a wodorotlenek sodu do drugiej. Podaj wniosek dotyczący rozpuszczalności osadu w kwasach i alkaliach.
b) Interakcja roztworu soli z kwasami w celu utworzenia lotnego związku.
Do probówki wlać 2 ml roztworu węglanu sodu i dodać niewielką objętość roztworu kwasu chlorowodorowego. Co zaobserwowano? Napisz równania reakcji chemicznych w postaci jonowej i molekularnej.
c) Interakcja roztworów soli z alkaliami z utworzeniem lotnego związku.
Wlej trochę roztworu soli amonowej do probówki, dodaj 1-2 ml roztworu wodorotlenku sodu i podgrzej do wrzenia. W probówce z mieszaniną reakcyjną sporządzić mokrą czerwoną próbkę lakmusową. Co zaobserwowano? Podaj wyjaśnienie. Napisz równania reakcji.
g ) Interakcje soli z aktywniejszymi metalami niż metal wchodzący w skład soli.
Wyczyść żelazny (stalowy) gwóźdź drobnym papierem ściernym. Następnie zanurzyć w roztworze siarczanu miedzi. Po pewnym czasie obserwuj uwalnianie miedzi na powierzchni paznokcia. Napisz odpowiednie równanie reakcji w postaci jonowej i molekularnej.
DOŚWIADCZENIE 4.Uzyskanie zasadowych i kwaśnych soli.
a) Przygotowanie wodorowęglanu ołowiu.
Dodać tlenek ołowiu (II) do roztworu octanu ołowiu (II) i gotować mieszaninę przez kilka minut. Ochłodzony roztwór odsącza się z osadu i przepuszcza przez niego strumień dwutlenku węgla. Co zaobserwowano? Przesączyć osad i wysuszyć między arkuszami bibuły filtracyjnej. Zaznacz kolor i naturę powstałego osadu ołowiu wodorowęglanu. Napisz równania reakcji. Zrób formułę graficzną otrzymanej soli.
b) Wytwarzanie wodorowęglanu magnezu.
Do bardzo mocno rozcieńczonego roztworu soli magnezu dodaj niewielką ilość roztworu węglanu sodu. Jaka substancja wytrąca się? Nasycony roztwór z osadem z dwutlenkiem węgla. Obserwować stopniowe rozpuszczanie osadu. Dlaczego tak się dzieje? Napisz równania reakcji.
DOŚWIADCZENIE 5.Uzyskiwanie złożonych soli.
a) Tworzenie związków o złożonym kationie.
Dodać kroplami roztwór amoniaku do probówki za pomocą 2-3 ml roztworu chlorku miedzi (II), aż wytrąci się osad wodorotlenku miedzi (II), a następnie dodać nadmiar roztworu amoniaku w celu rozpuszczenia osadu. Porównaj kolor jonów Cu 2+ z kolorem uzyskanego roztworu. Jakie jony są obecne w roztworze? Napisz równanie reakcji dla otrzymania złożonego związku.
b) Tworzenie związków o złożonym anionie.
Do 1-2 ml roztworu azotanu rtęci (II) dodać kroplami rozcieńczony roztwór jodku potasu, aby wytworzyć osad HgI 2. Następnie wlej nadmiar roztworu jodku potasu do rozpuszczenia osadu. Napisz reakcje otrzymywania złożonej soli.
DOŚWIADCZENIE 6.Wytwarzanie podwójnych soli (ałunu potasu).
Odważyć 7,5 g Al 2 (SO 4) 3 ∙ 18H 2 O i rozpuścić w 50 ml wody, przy czym do tego celu należy użyć dostatecznie dużej porcelanowej płytki. Oblicz równanie reakcji i zważ masę siarczanu potasu niezbędną do reakcji. Przygotować gorący nasycony roztwór siarczanu potasu i wlać go do porcelanowego naczynia z mieszaniem z roztworem siarczanu glinu. Po pewnym czasie obserwuj wytrącanie się kryształów glinowo-potasowo-ałunowych. Po ochłodzeniu i krystalizacji, wylać ług macierzysty, wysuszyć kryształy ałunu między arkuszami bibuły filtracyjnej i zważyć powstałe kryształy. Oblicz procent wydajności.
ZADANIA ROZLICZENIOWE
1. Przepuszczając nadmiar siarkowodoru przez 16 g roztworu siarczanu miedzi (II), otrzymano 1,92 g osadu. Znajdź ułamek masowy siarczanu miedzi w użytym roztworze i objętość zużytego siarkowodoru.
2. Do całkowitego wytrącenia miedzi w postaci siarczku z 291 cm3 roztworu siarczanu miedzi (II) o udziale masowym 10% zastosowano gaz otrzymany w reakcji 17,6 g siarczku żelaza (II) z nadmiarem kwasu solnego. Znajdź gęstość pierwotnego roztworu siarczanu miedzi.
3. Gaz uwalniany w trakcie oddziaływania roztworu K 2 S z rozcieńczonym kwasem siarkowym przepuszcza się przez nadmiar roztworu azotanu ołowiu (II). Otrzymany osad ma masę 71,7 g. Odnajdź objętość przereagowanego roztworu kwasu siarkowego, jeśli jego gęstość wynosi 1,176 g / cm3, a frakcja masowa wynosi 25%.
4. Do roztworu zawierającego 8 g siarczanu miedzi (II) dodano roztwór zawierający 4,68 g siarczku sodu. Osad odsączono, przesącz odparowano. Oznaczyć masę substancji w przesączu po odparowaniu i masę osadu siarczku miedzi.
5. Część siarczku żelaza (II) potraktowano nadmiarem kwasu chlorowodorowego. Powstały gaz w reakcji z 12,5 cm3 roztworu NaOH z udziałem masowym 25% i gęstością 1,28 g / cm3 tworzy sól kwasową. Znajdź masę oryginalnego siarczku żelaza.
6. Siarczek żelaza (II) o wadze 176 g potraktowano nadmiarem kwasu chlorowodorowego, a otrzymany gaz spalono w nadmiarze powietrza. Jaka objętość roztworu KOH z ułamkiem masowym 40% i gęstością 1,4 g / cm 3 jest potrzebna do całkowitej neutralizacji gazu wytwarzanego podczas spalania?
7. Podczas prażenia 100 g technicznego pirytu uzyskano gaz całkowicie zobojętniony 400 cm3 roztworu NaOH z ułamkiem masowym 25% i gęstością 1,28 g / cm3. Określ masową frakcję zanieczyszczeń w pirycie.
8. Do 2 g mieszaniny żelaza, tlenku żelaza (II) i tlenku żelaza (III) dodano 16 cm3 roztworu HCl o udziale masowym 20% i gęstości 1,09 g / cm3. Aby zneutralizować nadmiar kwasu, potrzeba było 10,8 cm3 roztworu NaOH z udziałem masowym 10% gęstości 1,05 g / cm3. Znajdź masy substancji w mieszaninie, jeśli objętość uwolnionego wodoru wynosi 224 cm 3 (NU).
9. Jest mieszanina Ca (OH) 2, CaCO3 i BaSO4 o masie 10,5 g. Po potraktowaniu mieszaniny nadmiarem kwasu chlorowodorowego wypuszczono 672 cm3 (IU) gazu, a 71,2 g kwasu przereagowało z masą udział w wysokości 10%. Określ masę substancji w mieszaninie.
10. Istnieje mieszanina chlorku baru, węglanu wapnia i wodorowęglanu sodu. Gdy 10 g tej mieszaniny rozpuszcza się w wodzie, nierozpuszczalna pozostałość jest równa 3,5 g. Kalcynując 20 g początkowej mieszaniny, jego masa zmniejsza się o 5,2 g. Odnajduj masowe frakcje substancji w początkowej mieszaninie.
11. Istnieje roztwór zawierający zarówno kwas siarkowy, jak i azotowy. Aby całkowicie zneutralizować 10 g tego roztworu, zużyto 12,5 cm3 roztworu KOH z udziałem masowym 19% i gęstością 1,18 g / cm3. Gdy nadmiar chlorku baru dodaje się do 20 g tej samej mieszaniny roztworu kwasu, wypada 4,66 g osadu. Znajdź masowe frakcje kwasów w mieszaninie.
12. Cały chlorowodór uzyskany ze 100 g mieszaniny KC1 i KNO3 rozpuszczono w 71,8 cm3 wody. Podczas kalcynowania 100 g tej samej mieszaniny soli pozostaje 93,6 g stałej pozostałości. Znajdź masową frakcję chlorowodoru w wodzie.
13. Przepuszczając 2 m3 powietrza (NU) przez roztwór Ca (OH) 2, otrzymano 3 g osadu soli kwasu węglowego. Znajdź objętość i ułamek masowy CO 2 w powietrzu.
14. Dwutlenek węgla przepuszcza się przez zawiesinę zawierającą 50 g CaCO3. Reakcja przyszła 8,96 dm 3 gazu (NU). Jaka masa CaCO 3 pozostała w fazie stałej?
15. Dodając wodę do CaO, jej masa wzrosła o 30%. Jaka część CaO (w% masy) została zgaszona?
16. Tlenek ołowiu (II) o masie 18,47 g ogrzewano w strumieniu wodoru. Po reakcji masa powstałego ołowiu i nieprzereagowanego tlenku wynosiła 18,07 g. Jaka jest masa tlenku ołowiu, który nie reaguje?
17. Tlenek węgla przepuszczany jest przez tlenek żelaza (III) po ogrzaniu. Masa stałej pozostałości po reakcji jest o 2 g mniejsza niż początkowa masa tlenku żelaza. Jaką objętość CO zrobiła reakcja (czy tlenek jest całkowicie zredukowany)?
18. Występuje 8,96 dm3 (NU) mieszaniny N 2, C02 i SO 2 o gęstości względnej wodoru 25. Po przepuszczeniu go przez nadmiar roztworu KOH objętość mieszaniny zmniejszyła się 4-krotnie. Znajdź objętość gazów w oryginalnej mieszaninie.
19. W dwóch szklankach jest 100 g roztworu HC1 z ułamkiem masowym 2,5%. W jednej szklance dodano 10 g CaCO3, w drugiej 8,4 g MgCO3. W jaki sposób masa okularów różni się po reakcji?
20. Jaką objętość (NU) dwutlenku siarki należy przepuścić przez 200 cm3 roztworu o zawartości wagowej 0,1% NaOH i gęstości 1 g / cm 3, aby uzyskać sól kwasu?
21. Jaka jest maksymalna ilość dwutlenku węgla (dwutlenku węgla) może pochłonąć 25 cm3 roztworu z 25% udziałem wagowym NaOH i gęstością 1,1 g / cm 3?
22. Jaka jest minimalna objętość roztworu z ułamkiem masowym 20% KOH i gęstością 1,19 g / cm 3, który może wchłonąć cały wytworzony dwutlenek węgla przy całkowitej redukcji 23,2 g magnetytu tlenkiem węgla?
23. Jaka jest minimalna masa KOH, którą należy poddać reakcji z 24,5 g kwasu ortofosforowego, aby tylko produkt będący diwodorofosforanem potasu?
24. Jaka jest minimalna masa Ca (OH) 2 dodawana do 16 g roztworu wodorowęglanu wapnia z ułamkiem masowym 5% soli w celu uzyskania średniej soli?
25. Jaką masę wodorofosforanu potasu należy dodać do roztworu zawierającego 12,25 g H 3 PO 4, tak aby roztwór zawierał tylko diwodorofosforan potasu?
26. Roztwór zawierał 56,1 g mieszaniny węglanów wapnia i magnezu w zawiesinie. Aby przekształcić je w wodorowęglany, zużyli cały dwutlenek węgla wytworzony przez spalanie 7 dm 3 (NU) etanu. Znajdź masę węglanu wapnia w początkowej mieszaninie.
27. Aby przekształcić 9,5 g mieszaniny wodoro- i diwodorofosforanu sodu w średnią sól, konieczne jest 10 cm3 roztworu o ułamku masowym NaOH 27,7% i gęstości 1,3 g / cm3. Znajdź masę fosforanu wodoru w mieszaninie.
28. Przepuszczając dwutlenek węgla przez roztwór zawierający 6 g NaOH otrzymano 9,5 g mieszaniny soli kwasowych i średnich. Znajdź ilość zużytego dwutlenku węgla.
29. Po przepuszczeniu 11,2 dm3 (NU) C02 przez roztwór KOH otrzymano 57,6 g mieszaniny soli kwasowych i średnich. Znajdź masę średniej soli.
30. Jaką masę kwasu ortofosforowego należy zobojętnić, aby otrzymać 1,2 g dihydro- i 4,26 g wodorofosforanu sodu?
31. NaOH dodano do roztworu kwasu siarkowego, otrzymując 3,6 g hydrosiarczanu i 2,84 g siarczanu sodu. Określ chemiczne ilości kwasu i zasady, które przereagowały.
32. Po przejściu chlorowodoru przez 200 cm3 roztworu NaOH o udziale masowym 10% i gęstości 1,1 g / cm3, ułamek masowy NaOH w otrzymanym roztworze zmniejszył się o połowę. Oznaczyć ułamek masowy NaCl w otrzymanym roztworze.
33. Rozpuszczając 14,4 g mieszaniny miedzi i jej tlenku (II) zużyto 48,5 g roztworu o frakcji masowej HNO 3 80%. Znajdź masowe frakcje miedzi i tlenku w początkowej mieszaninie.
34. Masę tlenku sodu wynoszącą 6,2 g rozpuszczono w 100 cm3 wody i otrzymano roztwór nr 1. Następnie do tego roztworu dodano kwas chlorowodorowy z ułamkiem masowym 10%, aż do uzyskania neutralnego ośrodka i uzyskania roztworu nr 2. :
1) frakcje masowe substancji w roztworach nr 1, 2;
2) masę roztworu HC1, który zneutralizował rozwiązanie nr 1.
35. 3 g cynku oddziałuje z 18,69 cm3 roztworu HCl z udziałem masowym 14,6% i gęstością 1,07 g / cm3. Po ogrzaniu otrzymany gaz przepuszcza się przez gorący CuO o wadze 4 g. Jaka jest masa otrzymanej miedzi?
36. Gaz uwolniony po obróbce wodorkiem wapnia z nadmiarem wody, przeszedł nad FeO. W rezultacie masa tlenku zmniejszyła się o 8 g. Znajdź masę CaH2 traktowaną wodą.
37. Podczas kalcynacji próbki CaCO 3 jej masa spadła o 35,2%. Stałe produkty reakcji rozpuszczono w nadmiarze kwasu solnego, otrzymując 0,112 dm3 (NU) gazu. Ustal masę oryginalnej próbki węglanu wapnia.
38. Azotan miedzi został rozłożony, a powstały tlenek miedzi (II) został całkowicie zredukowany przez wodór. Otrzymane produkty przepuszczono przez rurkę z P2O5, a masa rury po tym wzrosła o 3,6 g. Jaka jest minimalna objętość kwasu siarkowego z udziałem masy 88% i gęstość 1,87 g / cm3 potrzebna do rozpuszczenia uzyskanego w doświadczeniu miedź i jaka jest masa rozłożonej soli?
39. Po absorpcji tlenku azotu (IV) przez nadmiar roztworu KOH w chłodzie w nieobecności tlenu otrzymano 40,4 g KNO3. Jaka substancja wciąż się formuje i jaka jest jej masa?
40. W celu zobojętnienia 400 g roztworu zawierającego chlorowodorek i kwas siarkowy, zużyło 287 cm3 roztworu wodorotlenku sodu o udziale masowym 10% i gęstości 1115 g / cm3. Jeśli nadmiar roztworu chlorku baru zostanie dodany do 100 g początkowego roztworu, wypada 5,825 g osadu. Ustal masowe frakcje kwasów w początkowym roztworze.
41. Po przejściu dwutlenku węgla przez roztwór wodorotlenku sodu otrzymano 13,7 g mieszaniny soli o średnim i kwaśnym odczynie. Aby przekształcić je w chlorek sodu, potrzebne jest 75 g kwasu chlorowodorowego z ułamkiem masowym HCl 10%. Znajdź objętość pochłoniętego dwutlenku węgla.
42. Mieszaninę kwasów solnego i siarkowego o całkowitej masie 600 g roztworu o tych samych masach frakcji kwasów potraktowano nadmiarem wodorowęglanu sodu i uzyskano 32,1 dm3 gazu (NO). Znajdź ułamek masowy kwasów w początkowej mieszaninie.
43. Aby zneutralizować 1 dm 3 roztworu NaOH, zużyto 66,66 cm3 roztworu HNO 3 z udziałem masowym 63% i gęstością 1,5 g / cm3. Jaka objętość roztworu kwasu siarkowego o ułamku masowym 24,5% i gęstości 1,2 g / cm 3 byłaby konieczna do zneutralizowania tej samej ilości alkaliów?
44. W jakim stosunku objętościowym należy przyjąć roztwór kwasu siarkowego z ułamkiem masowym 5% i gęstością 1,03 g / cm3 i roztworem wodorotlenku baru o udziale masowym 5% i gęstości 1,1 g / cm 3 dla całkowitego zobojętnienia? Wyobraź sobie odpowiedź jako iloraz objętości roztworu alkalicznego w roztworze kwasu.
45. Oblicz minimalną objętość roztworu amoniaku o gęstości 0,9 g / cm 3 i masowej frakcji 25%, co jest konieczne do całkowitej absorpcji dwutlenku węgla uzyskanego przez rozkład 0,5 kg naturalnego wapienia z udziałem masowym węglanu wapnia równym 92%.
46. Do całkowitego przekształcenia 2,92 g mieszaniny wodorotlenku sodu i węglanu sodu w chlorek wymagane jest 1,344 dm3 chlorowodoru (NU). Znajdź masę węglanu sodu w mieszaninie.
47. Do 25 g roztworu siarczanu miedzi (II) o udziale masowym 16% dodano pewną ilość roztworu wodorotlenku sodu o udziale masowym 16%. Powstały osad odsączono, a następnie filtrat był alkaliczny. Aby całkowicie zobojętnić filtrat, potrzeba 25 cm3 roztworu kwasu siarkowego o stężeniu molowym 0,1 mola / dm3 roztworu. Oblicz masę dodanego roztworu wodorotlenku sodu.
48. Substancję otrzymaną przy całkowitej redukcji CuO o masie 15,8 g wodoru o objętości 11,2 dm 3 (NU) rozpuszczono przez ogrzewanie w stężonym kwasie siarkowym. Jaka jest objętość gazu (NU) uwolnionego w wyniku reakcji?
49. W celu całkowitego zobojętnienia 50 cm3 kwasu chlorowodorowego z ułamkiem masowym HCl 20% i gęstości 1,10 g / cm3, zastosowano roztwór wodorotlenku potasu z ułamkiem masowym KOH 20%. Jaka jest ilość chemiczna wody zawartej w powstałym roztworze?
50. Gaz otrzymany przez przepuszczenie nadmiaru CO2 ponad 0,84 g gorącego węgla, przesyła się do reakcji z 14,0 g ogrzanego tlenku miedzi (II). Jaka objętość roztworu kwasu azotowego ma ułamek masowy 63% i gęstość 1,4 g / cm 3, aby całkowicie rozpuścić substancję otrzymaną w ostatniej reakcji?
51. W przypadku kalcynacji do stałej masy azotanu miedzi (II), masa soli zmniejszyła się o 6,5 g. Jaką wagę soli rozłożono?
52. Gdy zastosowano nadmiar kwasu chlorowodorowego, 6,72 dm3 (NW) gazu zostało uwolnione w mieszaninie glinu z nieznanym metalem jednowartościowym, a masa mieszaniny została zmniejszona o połowę. Podczas traktowania pozostałości rozcieńczonym kwasem azotowym uwolniono 0,373 dm3 (NU) NO. Zidentyfikuj nieznany metal.
53. Masa próbki kredy wynosi 105 g, a ilość chemiczna elementu tlenowego w jego składzie wynosi 1 mol. Określić masę frakcji CaCO 3 w próbce kredy (tlen zawarty jest tylko w kompozycji węglanu wapnia).
54. W oddziaływaniu tlenku siarki (VI) z wodą otrzymano roztwór z ułamkiem masowym kwasu siarkowego 25%. Gdy do tego roztworu dodano nadmiar Ba (OH) 2, osadzono osad o masie 29,13 g. Jakie masy SO3 i H2O zostały zużyte na tworzenie roztworu kwasu?
55. Przy przepuszczaniu od SO 2 do 200 g roztworu z ułamkiem masowym NaOH wynoszącym 16%, powstała mieszanina soli, w tym 41,6 g soli kwasowej. Jaką masę zawiera 4,5% wagowych siarki, aby uzyskać SO2? Jaka jest waga soli średniej?
56. Oddziaływanie z 80 g roztworu Ca (NO 3) 2 przyjęło 50 g roztworu Na2CO3. Osad oddzielono, a następnie poddano go obróbce nadmiarem kwasu chlorowodorowego, po czym uwolniono 2,24 dm3 (NU) gazu. Jakie są masy frakcji soli w początkowych roztworach? Jaka jest ułamek masowy azotanu sodu w roztworze po oddzieleniu osadu?
57. Gdy cynk oddziałuje z kwasem siarkowym, powstaje 10 dm 3 (NU) mieszaniny SO2 i H2S z gęstością względną argonu wynoszącą 1,51. Jaka jest ilość chemicznego rozpuszczonego cynku? Jaka jest ułamek masowy SO 2 w mieszaninie gazów?
58. Próbkę mieszaniny trocin cynkowych i aluminiowych o łącznej masie 11 g rozpuszczono w nadmiarze roztworu alkalicznego. Oznaczyć objętość (NU) uwolnionego gazu, jeśli udział masowy cynku w mieszaninie wynosi 30%.
59. Wagę wodorotlenku sodu 4,0 g stopowano z wodorotlenkiem glinu, ważącym 9,8 g. Oblicz masę otrzymanego meta-gluminianu sodu.
60. Przy przetwarzaniu 10 g mieszaniny miedzi i aluminium ze stężonym kwasem azotowym w temperatura pokojowa uwolniony 2,24 dm 3 gazu (NU). Jaka objętość gazu (NU) zostanie uwolniona podczas przetwarzania tej samej masy mieszaniny z nadmiarem roztworu KOH?
61. Stop miedzi i aluminium o masie 20 g potraktowano nadmiarem zasady, nierozpuszczalną pozostałość rozpuszczono w stężonym kwasie azotowym. Otrzymaną sól wyodrębniono, kalcynowano do stałej masy i otrzymano 8 g stałej pozostałości. Oznaczyć objętość zużytego roztworu NaOH z udziałem masy 40% i gęstością 1,4 g / cm3).
62. Mieszaninę glinu i tlenku metalu (II) (tlenek amfoteryczny) o wadze 39 g potraktowano nadmiarem roztworu KOH, wydzielający się gaz wypalono, otrzymując 27 g wody. Nierozpuszczoną pozostałość rozpuszczono całkowicie w 25,2 cm3 roztworu o udziale masowym HCl 36,5% i gęstości 1,19 g / cm3). Określ tlenek.
63. Mieszaninę wiórków cynkowych i miedzianych potraktowano nadmiarem roztworu KOH, podczas gdy uwolniono gaz o wartości 2,24 dm3 (NU). Do całkowitego chlorowania tej samej próbki metalu wymagany był chlor o objętości 8,96 dm 3 (NU). Oblicz masową frakcję cynku w próbce.
64. Mieszaninę trociny żelaznej, aluminiowej i magnezowej o masie 49 g potraktowano nadmiarem rozcieńczonego H2SO4, otrzymując w ten sposób 1,95 mola gazu. Inną porcję tej samej mieszaniny o masie 4,9 g potraktowano nadmiarem roztworu alkalicznego, otrzymano 1,68 dm3 (NU) gazu. Znajdź masę metali w mieszance.
65. Jaka jest masa osadu powstającego podczas łączenia roztworów zawierających 10 g NaOH i 13,6 g ZnCl 2?
66. Są dwie porcje mieszaniny Al, Mg, Fe, Zn, takie same w kompozycji molowej, każda ważąca 7,4 g. Jedną porcję rozpuszczono w kwasie chlorowodorowym i otrzymano 3,584 dm3 gazu (NU), drugą w roztworze alkalicznym i Otrzymano 2,016 dm 3 gazu (NU). Wiadomo, że w obu mieszaninach są 3 Zn atomów na atom Al. Znajdź masę metali w mieszance.
67. Mieszaninę miedzi, magnezu i aluminium o masie 1 g potraktowano nadmiarem kwasu solnego. Roztwór przesączono, do przesączu dodano nadmiar roztworu NaOH. Osad oddzielono i kalcynowano do stałej masy 0,2 g. Pozostałość nierozpuszczoną po traktowaniu kwasem chlorowodorowym kalcynowano na powietrzu i otrzymano 0,8 g czarnej substancji. Znajdź ułamek masowy aluminium w mieszaninie.
68. Po podgrzaniu w strumieniu stopu tlenu cynku, magnezu i miedzi masa mieszaniny wzrosła o 9,6 g. Produkt częściowo rozpuszczono w alkaliach, a do rozpuszczenia konieczne było 40 cm3 roztworu o udziale masowym KOH 40% i gęstości 1,4 g / cm. 3 Do reakcji z tą samą częścią stopu potrzebny jest 0,7 mol HC1. Znajdź chemiczne ilości metali w stopie.
69. Stop miedzi i cynku o wadze 5 g potraktowano nadmiarem roztworu NaOH. Następnie stałą pozostałość oddzielono i potraktowano stężonym HNO3, tak otrzymaną sól wyizolowano, kalcynowano do stałej masy i otrzymano 2,5 g stałej pozostałości. Określić masę metali w stopie.
70. Stop miedzi i aluminium o masie 12,8 g potraktowano nadmiarem kwasu solnego. Nierozpuszczoną pozostałość rozpuszczono w stężonym kwasie azotowym, otrzymany roztwór odparowano, suchą pozostałość kalcynowano do stałej wagi i otrzymano 4 g ciała stałego. Określić udział masowy miedzi w stopie.
71. W jakim stosunku wagowym powinno brać się dwie porcje Al, tak aby po dodaniu jednego roztworu do alkaliów, a drugiego do równych ilości wodoru uwolnić do kwasu solnego?
72. Podczas przetwarzania mieszaniny tlenku aluminium i tlenku miedzi (II) z nadmiarem roztworu KOH, uwolniono 6,72 dm3 (NU) gazu, i przez rozpuszczenie tej samej części mieszaniny w stężonym HNO3 w temperaturze pokojowej otrzymano 75,2 g soli. Znajdź masę początkowej mieszaniny substancji.
73. Jaką masę tlenku miedzi (II) można przywrócić za pomocą wodoru otrzymanego w reakcji nadmiaru aluminium z 139,87 cm3 roztworu z 40% NaOH i gęstością 1,43 g / cm3?
74. Przy całkowitym utlenianiu 7,83 g stopu dwóch metali utworzyło się 14,23 g tlenków, w trakcie których nadmiar zasady pozostał nierozpuszczonym 4,03 g osadu. Określić skład jakościowy metali tworzących stop, jeżeli ich kationy mają stan utlenienia +2 i +3, a stosunek molowy tlenków wynosi 1: 1 (zakładamy, że tlenek metalu ze stanem utlenienia +3 ma właściwości amfoteryczne).
75. Dwie części aluminium o tej samej masie zostały rozpuszczone: jedna w roztworze wodorotlenku potasu, druga w roztworze kwasu chlorowodorowego. Jak wielkości ewoluowanych gazów (nos) odnoszą się do siebie?
76. Stop miedzi z aluminium o masie 1000 g potraktowano nadmiarem roztworu alkalicznego, nierozpuszczony osad rozpuszczono w kwasie azotowym, następnie roztwór odparowano, pozostałość kalcynowano do stałej wagi. Masa nowej pozostałości wynosi 0,398 g. Jaka jest masa metali w stopie?
77. Stop cynku i miedzi o masie 20 g potraktowano nadmiarem roztworu NaOH z udziałem masowym 30% i gęstością 1,33 g / cm3. Stałą pozostałość wyodrębniono i potraktowano nadmiarem stężonego roztworu HNO3. Sól powstałą podczas tego procesu izolowano i kalcynowano do stałej masy. Masa stałej pozostałości wynosiła 10,016 g. Oblicz masowe frakcje metali w stopie i objętość zużytego roztworu alkalicznego.
78. Stop miedzi i aluminium o masie 2 g potraktowano nadmiarem roztworu alkalicznego. Pozostałość przesączono, przemyto, rozpuszczono w HNO3, roztwór odparowano i kalcynowano do stałej wagi. Masa pozostałości po kalcynowaniu wynosiła 0,736 g. Oblicz masowe frakcje metali w stopie.
79. Chlorowanie mieszaniny żelaza, miedzi i aluminium wymaga 8,96 dm3 chloru (NU), a interakcja tej samej próbki z chlorowodorem wymaga 5,6 dm 3 (NU). Podczas interakcji z tą samą masą mieszaniny metali z alkaliami uwalniany jest 1,68 dm3 (NU) gazu. Znajdź chemiczne ilości metali w mieszaninie.
80. Ważenie wodorku potasu 5,0 g rozpuszczono w wodzie o objętości 80 cm3 i do otrzymanego roztworu dodano 0,81 g aluminium, a następnie odmierzono frakcje masowe otrzymanych roztworów z dokładnością do tysięcznych procenta.
WYKAZ LITERATURY
1. Barannik, V.P. Współczesna nomenklatura rosyjska związków nieorganicznych / V.P. Barannik // Journal of All-Union Chemical Society. D.I. Mendelejew. - 1983. - Tom XXVIII. - str. 9-16.
2. Wroblewski, A.I. Symulator chemii / A.I. Wróblewski. - 2nd ed., Pererab. i dodaj. - Mińsk: Krasiko-Print, 2007. - 624 str.
3. Glinka, N.L. Zadania i ćwiczenia z chemii ogólnej: studia. podręcznik dla uniwersytetów / red. V.A. Rabinovich i H.M. Rubina. - M .: Integral-Press, 2004. - 240 str.
4. Lidin, R.A. Zadania w chemii ogólnej i nieorganicznej: badania. podręcznik dla studentów wyższych. studia. instytucje / R.A. Lidin, V.A. Mleko, L.L. Andreeva; przez ed. R.A. Lidina. - M .: VLADOS, 2004. - 383 str.
5. Lidin, R.A. Podstawy nazewnictwa substancji nieorganicznych / R.А. Lidin [i in.]; przez ed. B.D. Stepina. - M .: Chemistry, 1983. - 112 str.
6. Stepin, B.D. Zastosowanie zasad IUPAC w nomenklaturze związków nieorganicznych w języku rosyjskim / B.D. Stepin, R.A. Lidin // Journal of All-Union Chemical Society. D.I. Mendelejew. - 1983. - Tom XXVIII. - str. 17-20.
| Wprowadzenie .............................................................................. Ogólne zasady dotyczące zakresu substancji nieorganicznych ............ .. Tlenki ....................................... .................................... Podstawowe tlenki .................................................................. ... Tlenki kwasowe ....................................... ............................ Tlenki amfoteryczne ....................................................... .. Uzyskiwanie tlenków .................................................................. Ćwiczenia do samodzielnej pracy Temat "Tlenki" ................................................................... Kwasy ............................................................................... Ćwiczenia do samodzielnej pracy nad tematem "Kwasy" .......................................................... Podstawy ............................................................ ......... .. Ćwiczenia do samodzielnej pracy na temat "Fundamenty" ................................................................ Sole ..................................................................................... Ćwiczenia do samodzielnej pracy na temat "Sole" ...................................................... Genetyczna zależność między klasami związków nieorganicznych ......................................... ............... .. Ćwiczenia do samodzielnej pracy na temat "Genetyczne połączenie między klasami związków nieorganicznych" ...................................................... Eksperymentalne eksperymenty na temat "Główne klasy związków nieorganicznych ............... ......... .. Zadania rozliczeniowe ..................................................... Referencje ................................... |
edukacyjne: naprawić pojęcie "serii genetycznej", "połączenia genetycznego"; nauczyć, jak tworzyć serie elementów genetycznych (metali i niemetali), aby uzupełnić równania reakcji odpowiadające serii genetycznej; sprawdź, w jaki sposób wiedza na temat chemicznych właściwości tlenków, kwasów, soli, zasad jest zrównana;
opracowanie: rozwijać umiejętność analizowania, porównywania, podsumowywania i wyciągania wniosków, tworzą równania reakcji chemicznych;
edukacyjne : promować tworzenie światopoglądu naukowego.
2. Zapewnienie klas: tabele "System okresowy", "Tabela rozpuszczalności", "Seria aktywności metali", instrukcje dla studentów, zadania do testowania wiedzy.
3. Porządek wykonania:
3.1. Badanie czołowe.
3.2. Rozwiązanie zadań.
3.3. Przeprowadź weryfikację opcji.
4. Układ raportu:
4.1. Napisz temat i cele praktycznej lekcji.
4.2. Nagraj rozwiązywanie problemów.
4.3. Rozwiąż własną wersję niezależnej pracy, decyzję o napisaniu w notatniku i przekaż nauczycielowi do sprawdzenia.
Postęp prac
1. Frontalna rozmowa na temat:
Co to jest połączenie genetyczne?
Połączenia genetyczne - są to połączenia między różnymi klasami na podstawie ich interkonwersji.
Czym jest seria genetyczna?
Rząd genetyczny - seria substancji - przedstawicieli różnych klas, które są związkami jednego pierwiastka chemicznego, połączonymi interkonwersjami i odzwierciedlającymi przemiany tych substancji. Podstawą tych serii jest ten sam element.
Jakie typy serii genetycznych są zwykle przydzielane?
Wśród metali występują dwa typy rzędów:
a) Seria genetyczna, w której alkalia działają jako baza. Ta seria może być reprezentowana przy użyciu następujących przekształceń:
metal → podstawowy tlenek → alkalia → sól
na przykład seria genetyczna potasu K → K 2 O → KOH → KCl
b) Szereg genetyczny, w którym podstawa jest nierozpuszczalną zasadą, wówczas serie mogą być reprezentowane jako łańcuch przekształceń:
metal → tlenek zasady → sól → baza nierozpuszczalna → tlenek zasadowy → metal
na przykład: Cu → CuO → CuCl2 → Cu (OH) 2 → CuO → Cu
Wśród niemetali można również rozróżnić dwa typy rzędów:
a) Genetyczne serie niemetali, w których rozpuszczalny kwas działa jako ogniwo w serii. Łańcuch przekształceń można przedstawić następująco: niemetalowy → kwasowy tlenek → rozpuszczalny kwas → sól.
Na przykład: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) Genetyczny rząd niemetali, gdzie nierozpuszczalny kwas: niemetalowy → kwasowy tlenek → sól → kwasowy → kwasowy tlenek → niemetalowy działa jako ogniwo w serii
Na przykład: Si → SiO2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Realizacja zadań dla opcji:
| Opcja 1 | Opcja 2 |
|
I opcja: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2
Opcja II: Na 2 SO 4, NaOH, Na, Na 2 O 2, Na 2 O
Zadanie domowe: wykreślić stopniowe przejście z wapnia do węglanu wapnia i przygotować raport na temat stosowania jakiejkolwiek soli w medycynie (z wykorzystaniem dodatkowej literatury).
Instrukcje do praktycznej lekcji
Związek genetyczny między głównymi klasami substancji nieorganicznych.
Cele: naprawić pojęcie "serii genetycznej", "połączenia genetycznego"; nauczyć się tworzyć serie elementów genetycznych (metali i niemetali) w celu uzupełnienia równań reakcji odpowiadających szeregowi genetycznemu; powtórz właściwości tlenków, kwasów, soli, zasad.
Postęp prac
Zapisz definicje pojęć:
Związek genetyczny - __________________________________________
Rząd genetyczny - ___________________________________________
Genetyczna seria metali, w których alkalia działają jako baza. może być reprezentowany w ogólności: metal → zasadowy tlenek → alkalia → sól. Zrób serię używając potasu. Napisz równania reakcji, za pomocą których możesz wykonać ten łańcuch przekształceń.
Genetyczna seria niemetali, w której rozpuszczalny kwas działa jako ogniwo w serii może być przedstawiony następująco: niemetalowy → kwasowy tlenek → rozpuszczalny kwas → sól. Zrób tę serię przy użyciu fosforu. Napisz równania reakcji, za pomocą których możesz wykonać ten łańcuch przekształceń.
Rząd genetyczny, w którym podstawa jest nierozpuszczalna może być reprezentowany przez łańcuch przekształceń: metal → tlenek zasadowy → sól → baza nierozpuszczalna → tlenek zasadowy → metal. Zbuduj tę serię za pomocą miedzi. Napisz równania reakcji, za pomocą których możesz wykonać ten łańcuch przekształceń.
Genetyczna seria niemetali, w której nierozpuszczalny kwas działa jako ogniwo w serii może być reprezentowany przez łańcuch przekształceń: niemetalowy → kwasowy tlenek → sól → kwasowy → kwasowy tlenek → niemetaliczny. Zbuduj tę serię za pomocą krzemu. Napisz równania reakcji, za pomocą których możesz wykonać ten łańcuch przekształceń.
Wykonuj zadania dla opcji:
| Opcja 1 | Opcja 2 |
|
1. Wybierz formuły tlenkowe w swojej wersji, wyjaśnij swój wybór, w oparciu o znajomość charakterystyki składu tej klasy związków. Zadzwoń do nich.
2. W kolumnie z formułą swojego wariantu znajdź formuły kwasowe i wyjaśnij swój wybór na podstawie analizy składu tych związków.
3. Określić wartościowości reszt kwasowych w kompozycji kwasowej.
4. Wybierz soli o wzorze i wymienić je.
5. Uzupełnij formuły soli, które można utworzyć za pomocą magnezu i kwasów w twoim wariancie. Zapisz je, nazwij.
6. W kolumnie z formułą swojej odmiany znajdź podstawowe formuły i wyjaśnij swój wybór na podstawie analizy składu tych związków.
7. W swoim wariancie wybierz wzory substancji, za pomocą których może reagować roztwór kwasu ortofosforowego (chlorowodorowego, siarkowego). Dokonaj odpowiednich równań reakcji.
9. Wśród formuł Twojej opcji wybierz formuły substancji, które mogą ze sobą współdziałać. Dokonaj odpowiednich równań reakcji.
10. Wykonaj łańcuch genetycznych wiązań związków nieorganicznych, który będzie zawierał substancję, której wzór podany jest w Twojej wersji pod numerem jeden.
Z tych substancji utworzyć linię genetyczną, używając wszystkich formuł. Napisz równania reakcji, dzięki którym możesz wykonać ten łańcuch przekształceń:
Ja opcja: ZnSO4, Zn, ZnO, Zn, Zn (OH) 2
IIopcja: Na2SO4, NaOH, Na, Na2O2, Na2O
Zadanie domowe: wykreślić stopniowe przejście z wapnia do węglanu wapnia i przygotować raport na temat stosowania jakiejkolwiek soli w medycynie (z wykorzystaniem dodatkowej literatury).
