28 գ սիլիցիում թթվածնով միացնելիս: Սիլիկոնային թթվածնի միացություններ
Kremniy.Obschaya harakteristika.Osnovnoe տարբերություն ածխածնի բացակայությունը n soedineniyah.Silitsidy.Soedineniya հետ կապի ջրածինը (silanes), օքսիդացում եւ gidroliz.Tetraftorid եւ սիլիցիումային tetrachloride, սիլիցիումի gidroliz.Geksaftorosilikaty.Kislorodnye soedineniya.Oksid (IV) .Silikagel.Kremnevaya թթուներ, սիլիկատներ, լուծույթներ եւ հիդրոդիսներ, բնական սիլիկատներ եւ ալիմինոսիլիկատներ, ցեոլիտներ, օրգազմիկի միացություններ, սիլիկոններ եւ սիլոքսաններ, բժշկության մեջ սիլիկոնային միացությունների օգտագործում:
Սիլիկոն (սիլիկիում), Si, պարբերական համակարգի IV խմբի քիմիական տարրը, ատոմային թիվ 14, ատոմային զանգված 28.086. Սիլիկոնն էլ ցուցադրվում է էլեկտրոնային էլեկտրոնիկայի sp3 հիբրիդիզացիայով
orbitals- ը: Սիլիկոնային ատոմի արտաքին էլեկտրոնային շերտում կան 3d-
orbitals (Si: 3s23p23d0),
Թթվածինից հետո սիլիկոնն ամենատարածված տարրն է մակերեսում: Ի տարբերություն ածխածնի ազատ վիճակում, սիլիկոնը բնության մեջ չի հայտնաբերվել: Դրանց ամենատարածված միացությունները սիլիկոնային օքսիդ (IV) SiO2 եւ սիլիկաթթուների աղեր, սիլիկատներ: Նրանք կազմում են երկրի խառնուրդը: Սիլիկոնային միացություններ են հայտնաբերվել բույսերի եւ կենդանիների մեջ: Քիմիական հատկություններով, սիլիկոն, ինչպես ածխածինը, ոչ մետաղական է, բայց նրա ոչ մետաղականությունը պակաս արտահայտված է, քանի որ ունի ավելի մեծ ատոմային շառավիղ
Սիլիկոն: ձեւավորում են գրեթե բոլոր մետաղներով միացություններ `հետ սիկիցիդներ (չի գտել միացություններ միայն Bi, Tl, Pb, Hg): Ստացված ավելի քան 250 սիլիցիդներ, որոնց կազմը (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si եւ այլն) սովորաբար չեն համապատասխանում դասական արժեքներին: Սիլիցիդները տարբերվում են refractoriness եւ կարծրություն; Ամենամեծ գործնական կարեւորությունը են ferrosilicon (reductant է հալեցման հատուկ համաձուլվածքների սմ. ֆեռոհամաձուլվածքների) եւ MoSi2 մոլիբդենի silicide (էլեկտրական ջեռուցիչներ, գազատուրբինային շեղբեր եւ այլն. դ.):
Սիլան Սիլիցիդների վրա հիդրոքլորական թթվի գործողության արդյունքում սիլիկոնի պարզագույն ջրածնի բաղադրությունը սիլան SiH4 է.
Silane- ը թունավոր գազ է, որը տհաճ հոտով է, որը ինքնաբերաբար այրում է: օդը
Դրանք ռեակտիվ են եւ ուժեղ նվազեցնող նյութեր են:
արձագանքել ջրի ջերմաստիճանում:
SiH4 + 2H2O → SiO2 + 4H2,:
Tetrafluoride- ը Silicon- ը արտադրվում է սիլիկոնային երկօքսիդի ֆտորինգով `տարրական ֆտորով:
Ֆլյորինգի գործընթացը իրականացվում է երկու փուլով `ֆլեյմի ռեակտորի մեջ, որը ղեկավարում է տարրական ֆտորինի ավելցուկը 1-ին փուլից մինչեւ 2-րդ փուլ:
Տեխնիկական արդյունքը սիլիցիումի արտադրությունն է `շարունակական ռեժիմով, բարձր եկամտաբերությամբ եւ արտադրանքի որակի մեջ:
Silicon tetrafluoride- ը SiF4- ը ձեւավորվում է հիդրոֆլուորային (հիդրոֆիլոր) թթվային ածխածնի վրա `ապակու վրա:
Na2SiO3 + 6HF ® 2NaF + SiF4 + 3H2O
Սիլիկոնային թթվածնի միացություններ
Սիլիկոնի ամենակարեւոր թթվածնային բաղադրիչը սիլիկոնային երկօքսիդը SiO2 (silica) է, որն ունի մի քանի բյուրեղային փոփոխություններ:
Ցածր ջերմաստիճանի փոփոխությունը (մինչեւ 1143 Կ) կոչվում է քվարց: Քվարցը ունի պիոզոէլեկտրական հատկություններ: Քվաթայի բնական տեսակներ. Ռոք բյուրեղյա, տոպազ, ամեթիստ: Սիլիցիի սորտերը քալկեդոնիա են, օպալ, ագատ,. ժասպեր, ավազ:
Silica- ը քիմիապես դիմացկուն է. այն ազդում է միայն ֆտորով, հիդրոֆիլական թթվի եւ ալկալիների լուծումների վրա: Այն հեշտությամբ անցնում է մի glassy պետություն (քվարցային ապակուց): Քվարցի ապակիները փխրուն են, շատ քիմիական եւ ջերմային դիմացկուն: Համապատասխան SiO2 սիլիկիկ թթուն չունի կոնկրետ կազմ: Սովորաբար սիլիկոնաթթունքը գրանցվում է որպես xH2O-ySiO2: Ձեռք բերված silicas: H2SiO3 (H2O-SiO2) - metasilicic (Tri-oksokremnievaya), H4Si04 (2H20-Si02) - orthosilicic (Tetra-oksokremnievaya), H2Si2O5 (H2O * SiO2) - dimetakremnievaya:
Սիլիկիկ թթուները վատ լուծելի նյութեր են: Սիլիկոնի պակաս մետաղադրամային բնույթին համեմատ, ածխածնի համեմատ, H2SiO3- ը որպես էլեկտրոլիտ, թույլ է, քան H2CO3:
Սիլիցիաթթուների ջրի մեջ սիլիցիաներին համապատասխանող լուծույթները (բացառությամբ ալկալային մետաղական սիլիկատների) չեն լուծվում: Լուծվող սիլիկատները hydrolyzed է հավասարման
2SiO3 - + H20 = Si2O52- + 20H-:
Լուծվող սիլիկատների կոնցենտրացված լուծումները կոչվում են հեղուկ ապակի: Նատրիումի եւ կալցիումի սովորական պատուհանների սիլիկատը ունի Na20-CaO-6Si02 բաղադրությունը: Այն ստացվում է ռեակցիայի միջոցով
Հայտնի է բազմազան սիլիկատներ (ավելի ճիշտ, oxosilicates): Օքսոսիլիկատների կառուցվածքում նկատվում է որոշակի օրինաչափություն. Բոլորը բաղկացած Si04 tetrahedra- ից, որոնք միմյանց հետ կապված են թթվածնի ատոմով: Ամենատարածված համակցություններ են tetrahedrons (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), որը, ինչպես կառուցվածքային ստորաբաժանումների, կարող է համատեղել շղթաներով, tapes, մետաղական ցանցեր եւ scaffolds (նկար 4):
Հիմնական բնական սիլիկատներն են, օրինակ, տաղտը (3MgO * H20-4Si02) եւ ասբեստ (SmgO * H2O * SiO2): Ինչպես SiO2- ով, ապակու (ամորֆ) վիճակը բնորոշ է սիլիկատների: Ապակու վերահսկվող բյուրեղացումով հնարավոր է ստանալ բյուրեղային վիճակ (sitalls): Սեղանները բնութագրվում են ուժեղ ուժով:
Բացի սիլիցիաներից, ալյումինոսիկատները տարածված են բնության մեջ: Aluminosilicates - շրջանակի oxosilicates, որտեղ մի մասը սիլիկոնային ատոմների փոխարինվում է trivalent Al; օրինակ, Na12 [(Si, Al) 04] 12:
Քանի որ սիլիկոնաթթվի համար կոլոիդային վիճակն առանձնանում է, երբ H2SiO3 թթվի աղերը անմիջապես չեն ազդում: Որոշ պայմաններում (օրինակ, տաքացվող) սիլիկոնաթթվի (sols) կոլոիդ լուծույթները կարող են վերածվել սիլիկոնաթթվի թափանցիկ, համասեռ գել նման զանգվածային գել: Գելները բարձր մոլեկուլային միացություններ են `SiO2 մոլեկուլների կողմից կազմված տարածական, շատ անկայուն կառուցվածքի, որի բացթողումները լի են H2O մոլեկուլներով: Երբ ջրազրկելը սիլիկոնային գել է, ստացվում է սիլիկացված գել `բարձր գովազդային հզորություն ունեցող ծակոտկեն:
Սիլիկոնային օքսիդ (IV) (silica) - երկրային խառնուրդի ամենատարածված բաղադրությունը, որը կազմում է իր զանգվածի 12% տարբեր հանքանյութերի տեսքով: Բացահայտում բյուրեղային եւ ամորֆային սիլիկայի միջեւ: Սիլիկոնային օքսիդի (IV) ամենաթեժ բանաձեւը SiO2 է: Այն բյուրեղացնում է ատոմային ցանցում:
1) բյուրեղային սիլիկոն `քվարցի հանքանյութի եւ դրա տեսակների (ռոք բյուրեղյա, կալկեդոն, ագատ, ջասեր, շերտ) տեսքով; քվարցը կազմում է քվարցային ավազի հիմքը, որը լայնորեն օգտագործվում է շինարարության եւ սիլիկատային արդյունաբերության մեջ:
2) Ամորֆային սիլիկոն `օպալային հանքային կազմի ձեւով SiO2 nH2O; ամորֆային սիլիկայի հողային ձեւերը դիատոմիտ են, Տրիպոլին (infusorial earth); Արհեստական ամորֆ անջուր սիլիկայի օրինակ է սիլիկատային գել, որը ստացվում է նատրիումի մետազիլիկատից.
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Սիլիկոնային գել ունի զարգացած մակերեւույթ, այդ իսկ պատճառով լավ ներծծում է խոնավությունը:
Սիլիկյան գել շաքարային գել է սիլիցիաթթուի (nSiO2 · mH2O) գերակշռող լուծումներից `pH\u003e 5-6: Խիտ հիդրոֆիլային սորբեն:
Ստանալով
Այն ձեռք է բերվում ալկալային մետաղական սիլիկատային լուծումների թթվայնացման միջոցով, որից հետո ձեւավորվում է գելը լվանալու եւ չորացնելու համար.
Սիլիկոնաթթու: SiO2- ը մի շարք սիլիկիկ թթուների անխիդիտ է
Silicic acid- ը կառուցված է եռանկյունային կառուցվածքային ստորաբաժանումներից (յուրաքանչյուր բաղադրամասում, սիլիկոնային ատոմը գտնվում է տտութեդրոնի կենտրոնում, եւ գլխավերեւում թթվածինային ատոմներ են): Շղթաներով միավորող կառուցվածքային կապերը ավելի կայուն պոլիսիլիկոնային թթուներ են կազմում.
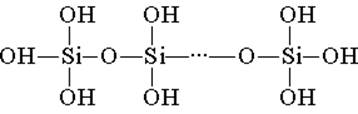
Նման բարդի կազմը կարող է արտահայտվել բանաձեւով (H2SiO3) n: Այնուամենայնիվ, սիլիկոնաթթու սովորաբար ներկայացված է H2SiO3 բանաձեւով: H2SiO3 - թթունը շատ թույլ է, ջրի մեջ քիչ լուծելի: Երբ ջեռուցվում է, այն հեշտորեն տարբերվում է նույն ձեւով, ինչպիսին է ածխաթթու գազը:
Բոլոր սիլիկիկ թթուները շատ թույլ են (ավելի յուղից):
Սիլիկատներ. Բոլոր սիլիցիաթթուների աղերը կոչվում են սիլիկատներ, սակայն, սովորաբար, սովորական գրականության մեջ, սիլիկատները ենթադրում են մետաքրիտալային թթվի աղեր: Նրանց կազմը սովորաբար ներկայացվում է բանաձեւով `տարրերի օքսիդների միացությունների տեսքով: Օրինակ, CaSiO3- ի կալցիումի սիլիկատը կարելի է արտահայտել որպես CaO × SiO2:
R2O × nSiO2 բաղադրամասի սիլիկատներ, որտեղ R2O- ն նատրիումի կամ կալիումի օքսիդն է, կոչվում են լուծվող ապակուց, եւ դրանց կենտրոնացված ջրային լուծույթները կոչվում են հեղուկ ապակի: Ամենակարեւորը նատրիումի լուծելի ապակին է:
Օդի մեջ կանգնած ժամանակ սիլիկատների լուծումները աճում են, քանի որ օդի ածխաթթու գազը (IV) օդում տեղադրում է իր սիլիցիաթթուն:
Silicic acid- ը գրեթե անլուծելի է ջրի մեջ `այս հատկությունը օգտագործվում է որպես որակական ռեակցիա իոն SiO32-:
Սիլիկատներ ստացվում են ալկալիների կամ կարբոնատների հետ սիլիցիայով միկրոֆոնով.
Սիլիկոնաթթվի լուծույթ եւ դրա լուծարման տեմպը կախված է մի քանի գործոններից, որոնցից ամենակարեւորը `ստացված սիլիցիումի երկօքսիդի փոփոխությունը, ցրման աստիճանը եւ ջերմաստիճանը: Երբ սիլիկատային ջեռոցը ջրով ջախջախելու դեպքում լուծելիության հավասարակշռությունը սահմանվում է մի քանի ժամվա ընթացքում, իսկ քվարցի դեպքում `շատ ամիսներ եւ նույնիսկ տարիներ:
ԲՆԱԿԱՆ ՍԻԼԻԿԱՏՆԵՐ (Լատինական SILEX, սեռ մահերի silicis - կայծքարի * բնական սիլիկատներ, ... Ն naturliche Silikate զ սիլիկատներ naturels ... եւ silicatos naturales) - դասի հանքանյութերի, silicic աղերի, իզո- եւ geteropolikremnievyh թթուներ. Բնական սիլիկատների տեսակարար կշիռը կազմում է երկրի խառնուրդի 75% -ը եւ հանքային տեսակների մոտ 25% -ը: Բնական է, որ հայտնի է ավելի քան 700 բնական սիլիկատներ, այդ թվում `ռոքի ձեւավորման ամենակարեւոր օգտակար հանածոները (շաքարավազներ, պիրոքսսեններ, ամֆիբոլներ, մկաններ եւ այլն)
Aluminosilicates - բնական եւ սինթետիկ սիլիկատների մի խումբ, որի բարդ անիոնները պարունակում են սիլիկոն եւ ալյումին: Բարդ anions- ի օրինակներ. -, -, 2 -. Na +, K +, Mg2 +, Ca2 + եւ երբեմն Ba2 + եւ Li +- ը հանդես են գալիս որպես կատիոններ:
Բնական ալյումոսիլիկատները ամենատարածված հանքանյութերն են, դրանք կազմում են երկրի ընդերքի զանգվածի 50% -ը: Դրանք ընդգրկում են շաքարավազներ (albite, orthoclase, anortite), կավե հանքանյութեր եւ միկա:
Զեոլիտներ - Սրանք կալցիումի, նատրիումի, կալիումի, բարիումի եւ այլ տարրերի ջրալի ալյումինիկացուկներ են: Զեոլիտների խումբը ներառում է ավելի քան քառասուն հանքանյութեր, որոնք տարբերվում են կազմի մեջ (հատկապես բյուրեղային հիդրատորիում ջրային մոլեկուլների քանակից) եւ, իհարկե, ֆիզիկական եւ քիմիական հատկություններում: Սակայն այս խմբի հանքային գրեթե բոլոր ներկայացուցիչները ունեն ընդհանուր առանձնահատկություն `լավ սորբենտներ են, տիրապետում են ion փոխանակման հատկություններ, կարող են փոխել առանձին իոնների շարժունակությունը եւ աշխատել որպես մոլեկուլային մաղձ: Եվ համեմատաբար վերջերս, այդ հանքանյութերը գտել են ամբողջովին անսպասելի օգտագործումը, նրանք սկսեցին օգտագործել գյուղատնտեսության մեջ:
Organosilicon միացություններ - միացություններ, որոնց մոլեկուլներում կա սիլիկոն եւ ածխածնի ատոմների միջեւ կապ: Organosilicon միացությունները երբեմն կոչվում են սիլիկոններ, լատինական սիլիկոնային անունից «սիլիկոն»: Organosilicon միացությունները օգտագործվում են քսանյութեր, պոլիմերներ, ռետիններ, ռետիններ, սիլիկոնային հեղուկներ եւ էմուլսիա արտադրելու համար: Organosilicon միացությունները օգտագործվում են կոսմետիկայի, կենցաղային քիմիկատների, ներկերի եւ լաքերի, լվացքի նյութերի մեջ: Ընդհանուր օրգանական միացությունների հիման վրա արտադրվող օրգանական միացությունների վրա հիմնված արտադրանքի տարբերակիչ առանձնահատկությունները, որպես կանոն, ավելի բարձր ցուցանիշներ եւ բնութագրեր են, ինչպես նաեւ մարդու օգտագործման անվտանգությունը: Սիլիկոնային պոլիմերները կարող են օգտագործվել մաստակ պատրաստելու համար: Organosilicon միացությունների եւ կնիքի պոլիմերացումը անվտանգ է մարդկանց համար եւ չի պահանջում արդյունահանումը:
Siloxanes - մոլեկուլում փոխարինող սիլիկոնային եւ թթվածինային ատոմների պարունակող միացություններ: Ամենաբարձրը ունեն բարձր մոլեկուլային քաշի siloxanes - polyorganosiloxanes; տես Սիլիկոնային պոլիմերներ:
Սիլիկոններ (polyorganosiloxanes) - oxygenated բարձր մոլեկուլային քաշի organosilicon միացություններ հետ քիմիական բանաձեւի n, որտեղ R = օրգանական խումբը (methyl, ethyl կամ ֆենիլ). Հիմա սա սահմանումը պահպանենք արդեն չափազանց հազվադեպ, իսկ «սիլիկոն» են համադրվում որպես polyorganosiloxanes (օրինակ սիլիկոնե յուղեր, ինչպիսիք են ICP, ջրի վանող տեսակի ngL կամ ցածր մոլեկուլային քաշը կաուչուկների SKTN) եւ նույնիսկ organosilicon monomers (տարբեր silanes), blurring տարբերակումը ժամկետների «silicone» եւ « սիլիկոն »:
Մետաղական սիլիկոն  Crystal Silicon- ը
Crystal Silicon- ը
Սիլիկոն (Si): Այս քիմիական տարրը կազմում է երկրի կեղեւի կազմի 1/4 մասը: Քուչ, ռոք բյուրեղյա, ավազ, կավ, գրանիտ, միկա, ասբեստ, այս ամենը սիլիկոնային քիմիական միացություններ
Սիլիկոնը միջանկյալ տարր է (amfhoteric) եւ կարող է ցուցադրել ինչպես մետաղական եւ ոչ մետաղական հատկությունները: Այն կարող է ստեղծել քիմիական միացություններ, ինչպես մետաղների եւ ոչ մետաղների հետ:
Մաքուր սիլիկոն - քիմիապես պարզ գույնի մոխրագույն գույն, ծանր, հուսահատ եւ փխրուն: Crystal Silicon- ը Այն ունի մետաղյա փայլ եւ լայնորեն օգտագործվում է կիսահաղորդչային արդյունաբերության մեջ (դա կիսահաղորդիչ է):
Սիլիկոնները կարող են ձգվել նման բյուրեղային վիճակում ( բյուրեղային սիլիկոն), եւ ամորֆ վիճակում ( ամորֆային սիլիկոն): Բյուրեղային սիլիկոնները ձեւավորվում են ամորֆային սիլիկոնային լուծույթով հալեցված մետաղի մեջ: Իր հերթին, բյուրեղային սիլիկոնները շատ փխրուն նյութ են եւ հեշտությամբ ջախջախվում է ամորֆային փոշու մեջ: Այսպիսով, ամորֆային սիլիկոն բյուրեղային սիլիկոնի բյուրեղների բեկորն է:
Ազատ երկրում սիլիկոնին բավականին դժվար է ձեռք բերել: Արդյունաբերական արտադրանքը կապված է քվարցի վերականգնման հետ, որի քիմիական բանաձեւը SiO 2 է, կրճատման ռեակցիան արտադրվում է տաք կոքով (ածխածնի) կողմից:
SiO 2 + C → CO 2 + Si
Լաբորատորիայում մաքուր սիլիցիում մետաղական մագնեզիումով սիլիկյան ավազից նվազեցվում է հետեւյալ ռեակցիան `
SiO 2 + 2Mg → Si + 2MgO:
Այս ռեակցիայի ընթացքում ձեւավորվում է ամորֆային սիլիկոնի շագանակագույն փոշի: Երբ ջեռուցվում է, փոշին կարող է դանդաղ արձագանքել alkalis- ների կենտրոնացված լուծույթներով (օրինակ, նատրիումի հիդրօքսիդ NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - արդյունքում առաջացող բարդ նյութը, որը կոչվում է հեղուկ ապակի:
Հետաքրքիր է, որ սիլիկոնի քիմիական ակտիվությունը կախված է իր բյուրեղների չափերից: Co-crystalline silicon- ը քիմիապես ավելի ակտիվ է, քան ամորֆը: Վերջինը ֆտորինի հետ հեշտությամբ արձագանքում է նույնիսկ սովորական ջերմաստիճանում, եւ 400-600 0 C ջերմաստիճանի դեպքում նա արձագանքում է թթվածին, քլորին, բրոմին, ծծումբին `համապատասխան քիմիական միացություններ կազմելու համար: Շատ բարձր ջերմաստիճանի դեպքում սիլիկոնն արձագանքում է ազոտի եւ ածխածնի հետ, համապատասխանաբար, նիտրիտ եւ սիլիկոնային կարբիդ:
Եթե դուք փորձում եք լուծարել սիլիցիում հիդրոֆլուորային HF (հիդրոֆիլային) եւ ազոտային HNO 3 թթուների խառնուրդում, ապա ռեակցիան չի անցնի: Բայց եթե դուք վարում եք քիմիական ռեակցիա ալկալայի հետ, օրինակ, կալիումի հիդրոօքսիդի հետ, ապա ռեակցիան տեղի կունենա սիլիցիաթթու աղի ձեւավորման հետ
Si + KOH → K 2 SiO 3 + H 2
Եթե կավիճում կավիճով սիլիկեթով (ավազով) կալին է ընկնում, ստացվում է շատ բյուրեղային բովանդակություն: Կարբորունդում SiC
SiO 2 + 3C → SiC + 2CO
Կարբորունդում - շատ ծանր եւ հրակայուն նյութ: Արդյունաբերությունում այն մեծ քանակությամբ արտադրվում է այդ հատկությունների պատճառով: Հետաքրքիր է, որ կարբորունդի բյուրեղյա վանդակը նման է ամենադժվար նյութի վանդակին `ադամանդ, բայց դրա մեջ անհատական ածխածնի ատոմները միանգամայն փոխարինվում են սիլիկոնային ատոմներով:
Բարձր ջերմաստիճաններում, ինչպես նաեւ քիմիական ռեակցիաների ընթացքում, մետաղական միացությունների վրա թթուների գործողությունների արդյունքում սիլիկոնով, silane SiH 4.
Սիլան - ինքնուրույն այրվող անգույն գազ է: Այն կարող է պայթել օդում `սիլիցի եւ ջրի ձեւավորման համար:
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
Եթե սիլիկոնային օքսիդի SiO 2 ջերմացվում է քլորի հոսքի ածխածնի առկայության մեջ, ապա քիմիական ռեակցիան տեղի է ունենում սիլիկոնային քլորիդի ձեւավորման միջոցով
SiO 2 + 2C + 2 Cl 2 → SiCl 4 + 2CO
Սիլիկոնային քլորիդ - դա հեղուկ է, որի եռացող ջերմաստիճանը ընդամենը 54 ° C է: Սիլիկոնային քլորիդը հեշտությամբ լուծարվում է ջրի մեջ `երկու թթուների լուծույթի ձեւավորմամբ` սիլիկոնային եւ հիդրոքլորիդ
SiCl 4 + H 2 O → H 2 SiO 3 + HCl
Եթե այս քիմիական ռեակցիան առաջանում է խոնավ օդի մթնոլորտում, երկու թթուների ձեւավորման ժամանակ կհայտնվի հաստ ծուխ:
Սիլիկոն ֆտորիդ SiF 4- ը, որը ձեւավորվում է հիդրոֆիլական թթու եւ սիլիկոնային օքսիդի քիմիական ռեակցիայի արդյունքում
SiO 2 + 4HF → SiF 4 + 2H 2 O
Սիլիկոն ֆտորիդը գունավոր գազ է «ուժեղ» հոտով: Ինչպես նաեւ սիլիկոնային քլորիդը, ջրի մեջ այս գազը ձեւավորում է երկու թթու `սիլիկոն եւ հիդրոֆտորիկ: Սակայն հետաքրքիր է, որ սիլիկոն ֆտորիդը կարող է փոխազդել հիդրոֆլորոր թթվի հետ hexafluorosilicic թթու որոնց քիմիական բանաձեւը H 2 SiF 6 է: Դրա աղերը եւ թթունն ինքնին թունավոր են:
Սիլիկոն
Բազային մետաղներ եւ ոչ մետաղներ
Այս դասում կքննարկեք «Սիլիկոն» թեմայով: Մտածեք սիլիցիի մասին տեղեկատվությունը `նրա էլեկտրոնային կառուցվածքը, որտեղ սիլիկոնն բնության մեջ է, ուսումնասիրում է սիլիկոնային allotropy, բացատրում է ֆիզիկական եւ քիմիական հատկությունները: Իմացեք, թե որտեղից է սիլիկոն օգտագործվում արդյունաբերության եւ այլ ոլորտներում, թե ինչպես է այն արտադրվում: Դուք կծանոթանաք սիլիցիումի, սիլիցիաթթուի եւ դրա աղերի `սիլիկատների հետ:
Թեմա: Բազային մետաղներ եւ ոչ մետաղներ
Դաս `սիլիկոն: Անբնական գազեր
Սիլիկոնն ընդերքի ամենատարածված քիմիական տարրերից է: Դրա բովանդակությունը գրեթե 30% է: Բնականաբար, այն հիմնականում հայտնաբերված է սիլիցիումի երկօքսիդի, սիլիկատների եւ ալյումինեիլիկատների տարբեր ձեւերի տեսքով:
Սիլիկոնն անխտիր է գրեթե բոլոր բաղադրություններում: Այս դեպքում սիլիկոնային ատոմները հուզված վիճակում են: Նկար. 1.
Այս վիճակին հասնելու համար 3-րդ էլեկտրոններից մեկը զբաղեցնում է թափուր տեղ 3p orbitals- ում: Այս դեպքում, հենակետային երկրում 2 չկատարված էլեկտրոնների փոխարեն, հուզված վիճակում գտնվող սիլիկոնային ատոմը կունենա 4 չբաշխված էլեկտրոն: Նա կկարողանա փոխանակման մեխանիզմով ստեղծել 4 կովալենտրոն պարտատոմսեր:


Սիլիկոնային ատոմները չեն հակասում բազմակի կապերի ձեւավորմանը, այլ ձեւավորում են միացություններ, որոնք առանձին կապերով են `Si-O-: Սիլիկոն, ի տարբերություն ածխածնի, բնորոշ չէ allotropy- ի:
Մեկը allotropic փոփոխությունը բյուրեղային սիլիկոն էորտեղ յուրաքանչյուր սիլիկոնային ատոմ է sp 3 հիբրիդացման մեջ: Նկար. 2, 3. Բյուրեղային սիլիկոն մետաղական փայլով մուգ մոխրագույնի կոշտ, հուսահատ եւ ամուր բյուրեղային նյութ է: Նորմալ պայմաններում `կիսահաղորդիչ: Երբեմն էլ ամորֆային սիլիկոն է արտանետվում նաեւ որպես սիլիկոնի այլ ալտրոպիկ փոփոխություն: Այն մուգ շագանակագույն փոշի է, ավելի քիմիական ակտիվ, քան բյուրեղային սիլիկոն: Արդյոք դա ալլոտրոպիկական փոփոխություն է, թե ոչ:
Սիլիկոնի քիմիական հատկություններ
1. Հալոգենների հետ փոխազդեցություն
Si + 2F 2 → SiF 4
2. Այն ժամանակ, երբ ջերմաստիճանը թթվածինով այրվում է սիլիկոնային, սիլիկոն (IV) ձեւավորվում է:
Si + O 2 → SiO 2
3. Բարձր ջերմաստիճանի դեպքում սիլիկոնը համագործակցում է ազոտի կամ ածխածնի հետ:
3Si + 2N 2 → Si 3 N 4
4. Սիլիկոնը չի արձագանքում թթուների ջրային լուծույթներին: Բայց դա թափվում է ալկալիների մեջ:
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. Երբ սիլիցիումը մետաղների հետ կապվում է, սիլիցիդները ձեւավորվում են:
Si + 2Mg → Mg 2 Si
6. Սիլիկոնն ուղղակիորեն չի համագործակցում ջրածնի հետ, սակայն սիլիցիումի ջրածնի միացությունները կարող են ձեռք բերել ջրի հետ սիլիցիդների փոխազդեցությունը:
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (silane)
Silanes- ը նման է ալկանների կառուցվածքին, բայց զգալիորեն ակտիվ են: Առավել կայուն monosilane- ը օդում այրելի է:
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
Ստանալով սիլիկոն
Silicon- ը ձեռք է բերվում սիլիկոնային օքսիդի (IV)
SiO 2 + 2Mg → Si + 2MgO
Առաջնություններից մեկը բարձր մաքրության սիլիկոնն է: Այդ նպատակով տեխնիկական սիլիկոն փոխանցվում է սիլիկոնային թետախախին: Արդյունքում թթագախոիդը կրճատվում է սիլանով, եւ սիլանը ջերմացվում է սիլիկոնային եւ ջրածնի մեջ:
Սիլիկոնը կարող է ձեւավորել երկու օքսիդ `SiO 2 - սիլիկոնային օքսիդ (IV) եւ SiO - սիլիկոնային օքսիդ (II):
SiO - սիլիկոնային օքսիդ (II) - Սա ամորֆ մուգ շագանակագույն նյութ է, որը ձեւավորվում է սիլիցիումի սիլիկոնային օքսիդով (IV)
Si + Սիո 2 → 2 Սիո.
Չնայած իր կայունությանը, այս նյութը գրեթե երբեք չի օգտագործվում:
SiO 2 - սիլիկոնային օքսիդ (IV)


Այս նյութը կազմում է երկրի խառնուրդի 12% -ը: Նկար. Այն ներկայացնում է այնպիսի օգտակար հանածոներ, ինչպիսիք են ռոք բյուրեղները, քվարցը, ամեթիստը, ցիտրինը, ժասպերը, քալկեդոնը: Նկար. 5
SiO 2 - սիլիկոնային օքսիդ (IV) - ոչ մոլեկուլային կառուցվածքի նյութ:
Նրա բյուրեղյա վանդակն ատոմային է: Նկար. 6. SiO 2 բյուրեղները ունեն tetrahedron ձեւ, որոնք միմյանց փոխկապակցված են թթվածնային ատոմների: (SiO 2) n մոլեկուլի բանաձեւը ավելի ճիշտ կլինի: Քանի որ SiO2- ը ձեւավորում է ատոմային կառուցվածքի եւ CO 2- ը `մոլեկուլային կառուցվածքից, ակնհայտ է դրանց հատկությունների տարբերությունը: CO2- ը գազ է, իսկ SiO 2- ը կոշտ թափանցիկ բյուրեղային նյութ է, որը լուծելի չէ ջրի եւ հրակայուն վիճակում:
Քիմիական հատկություններSiՄոտ 2
1. Սիլիկոնային օքսիդ (IV) SiO 2 է թթու օքսիդ: Այն ջրի հետ չի արձագանքում: Silicic acid- ը չի կարող ձեռք բերել SiO- ի խոնավության շնորհիվ: Դրա աղերը, սիլիկատները կարող են ձեռք բերել SiO 2- ը տաք ալկալային լուծույթներով:
SiO 2 + 2 NaOH Na 2 SiO 3 + H 2 O
2. Reacts է ալկալիների եւ ալկալային մետաղների կարբոնատներով:
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. համագործակցում է մետաղների հետ:
SiO 2 + 2Mg → Si + 2MgO
4. Հիդրոֆլորորաթթուով ռեակցիա:
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
Քիմիական նյութերի քիմիական հատկություններ եւ սիլիկատներ
Սիլիկիկ թթու ստացում
Silicic acid- ը precipitates որպես պոլիմերային բարդ: Silicic Acid Formulas -
H 2 SiO 3 (meta ձեւ) եւ H 4 SiO 4 (ortho ձեւ) - արտացոլում է տարրերի հարաբերակցությունը, բայց ոչ ճշմարիտ կազմը: Սովորաբար, ինքնաթիռում, սիլիկոնաթթվի կազմը պատկերված է որպես նկար: 7
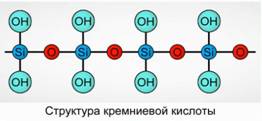
Silicic թթու համար միշտ օգտագործվում է H 2 SiO 3 բանաձեւը:
1. Հ 2 Սիո 3 քայքայվում է, երբ ջեռուցվում է
H 2 SiO 3 H 2 O + SiO 2 (սիլիկատային գել)
2. Գործում է ալկալիների լուծույթներով
H 2 SiO 3 + 2 NaOH Na 2 SiO 3 + 2H 2 O
Silicic acid աղեր - սիլիկատներ - վերաբերում են իոնային միացությունների: Սրանք կոշտ անգույն նյութեր են: Միայն երկաթի մետաղական սիլիկատները, բացառությամբ լիտիումի, ջրով լուծվում են:
1. Լուծվող սիլիկատներ են hydionized by anion
Na 2 SiO 3 + H 2 O ⇆ NaHSio 3 + NaOH
2. Լուծվող սիլիկատներ փոխազդեց ուժեղ թթուներով:
Na 2 SiO 3 + 2HCl → H 2 SiO 3 ↓ + 2NaCl
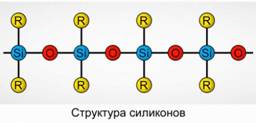
Polyorganosiloxanes (սիլիկոններ)
Polyorganosiloxanes (silicones) են oxygenated, բարձր մոլեկուլային քաշը organosilicon միացություններ:
Ռ 2 [ Սիո] n
R- օրգանական խումբ (մետիլ, էթիլ կամ ֆենիլ): Siloxanes- ի կառուցվածքի հիմքը փոխարինող սիլիկոնային ատոմների եւ թթվածնի շղթա է: Նկար 8: Շղթայի երկարությունը եւ օրգանական խմբերը տարբերվում են տարբեր հատկություններով սիլիկոններ: Փոխելով պոլիմերացման պայմանները, դուք կարող եք ստանալ տարբեր երկարությունների մոլեկուլներ:


Կարճ շղթայական պոլիմերները հեղուկ են, երկարը `արժեքավոր քսանյութեր: Նկար. 9, որոնք պահպանում են իրենց հատկությունները հսկայական ջերմաստիճանում
100 0 С- ից մինչեւ + 300 0 С. Ավելի երկար մոլեկուլներ ձեւավորում ռետիններ, որոնք ցածր ջերմաստիճաններում կորցնում են իրենց էլաստիկությունը: Հագեցածության բարձր դիմադրություն ունենալու դեպքում քիմիապես աներեւակայելի են: Նկար. 10. Այն առաջացնում է դրանց կիրառման տարբեր տարբերակներ: Նրանք կարող են օգտագործվել արհեստական սրտի կամ երիկամների մեքենաներ ստեղծելու համար եւ կարող են օգտագործվել որպես կոշիկի կոշիկ: Սիլոքսանային պոլիմերները բժշկության մեջ օգտագործվում են տարբեր փափուկ հյուսվածքների իմպլանտներ ստեղծելու համար, քանի որ նման պոլիմերները քիմիապես ներարկիչ են եւ չեն մերժվում մարմինը: Նրանք խոնավ են ջրով: Այն օգտագործվում է քրքում: Այս կրեմը իր ձեռքերում կիրառելիս նա կփոխարինի ռետինե ձեռնոցներ:
Անօրգանական այգի
Նատրիումի սիլիկատով լցված թափանցիկ բուխարիում գունավոր աղերի բյուրեղները, օրինակ, պղնձի սուլֆատը: Որոշ ժամանակ անց կարելի է տեսնել, որ բյուրեղներից կազմված բարակ խոռոչ խողովակները, որոնք բաղկացած են անլուծելի սիլիկատներից: Նկար. 11

Ստանալով «հիմար» մածուկ
Նատրիումի սիլիկատի եւ բժշկական ալկոհոլի հավասար ծավալները խառնվում են: Աղտոտվածությունը ֆիլտրացված եւ սեղմված է, որպեսզի սպառել ալկոհոլը: Սա խայտաբղետ է: Նկար. 12. Այն կոչվում է այնպես, որ այն նախատեսված էր օգտագործել որպես պատուհան պատուհանների համար: Սակայն պարզվեց, որ այն ունի այնպիսի հատկություններ, որ այն չի կարող օգտագործվել իր նպատակային նպատակների համար: Եթե դուք գլորում եք գնդակը եւ նետում այն հատակին, ապա այն կթողարկվի որպես ռետինե գնդակ: Եթե սեղանին դրված է, ապա այն տարածվում է որպես հեղուկ: Եթե հարվածեք ամուր օբյեկտին, ապա այն կկորցնի պինդ մարմնի պես: Որոշ ժամանակ անց, երբ ալկոհոլը կաթում է, այս խառնուրդը պարզապես քանդվում է:
![]()
Ամփոփելով դասը
Այս դասում դուք սովորում եք «Սիլիկոն» թեմայով: Մենք ուսումնասիրեցինք սիլիցիումի մասին տեղեկատվությունը `նրա էլեկտրոնային կառուցվածքը, որտեղ սիլիկոնները գտնվում են բնության մեջ, սովորել են սիլիցիումի բոլորաթիթեղը, բացատրել են նրա ֆիզիկական եւ քիմիական հատկությունները: Նրանք սովորում էին, թե որտեղից է սիլիկոն օգտագործվում արդյունաբերության եւ այլ ոլորտներում, թե ինչպես է այն արտադրվում: Դուք հանդիպեցիք սիլիցիում, սիլիցիաթթու եւ դրա աղեր `սիլիկատներ:
Հղումներ
1. Ռուդզիտ Գ.Է. Քիմիա: Ընդհանուր քիմիայի հիմունքները: Դասարան 11: ուսումնական հաստատությունների համար դասագիրք. Հիմնական մակարդակ / Գ. Ռուդզիտ, Ֆ.Գ. Ֆելդման. - 14-րդ հրատարակություն: - Մ., Լուսավորություն, 2012:
2. Պոպել Պ.Պ. Քիմիա: 8 դաս: Դասավանդում հանրակրթական դպրոցների / PP- ի համար: Popel, L.S. - Կ.: ИЦ "Academy", 2008. - 240 էջ: Ill.
3. Գաբրիելյան Օ.Ս. Քիմիա: 11-րդ դասարան: Հիմնական մակարդակը: 2-րդ հրատարակություն, Sr. - Մ., Դրոֆա, 2007. - 220 էջ.
Տնային աշխատանք
1. №№2-4 (էջ 138) Ռուդզիտ Գ.Է. Քիմիա: Ընդհանուր քիմիայի հիմունքները: Դասարան 11: ուսումնական հաստատությունների համար դասագիրք. Հիմնական մակարդակ / Գ. Ռուդզիտ, Ֆ.Գ. Ֆելդման. - 14-րդ հրատարակություն: - Մ., Լուսավորություն, 2012:
2. Որոնք են polyorganosiloxanes- ի դիմումները:
3. Սիլիկոնի ալլոտրոպական փոփոխությունների հատկությունները համեմատեք:
