Սիլիկոնի կառուցվածքի սխեմա: Էլեկտրոնային շերտերի կառուցվածքը
Ատոմային կառուցվածք Պաշտոն PS: III դ. խմբի IV, առաջատար; Kernel վճարը `+14 Si; Հարաբերական ատոմային զանգված `Ar (Si) = 28 Ատոմային կառուցվածքը` p = 14, e = 14, n = = 14 Էլեկտրոնային բանաձեւը `+14 Si 2e; 8e, 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Nemetall;
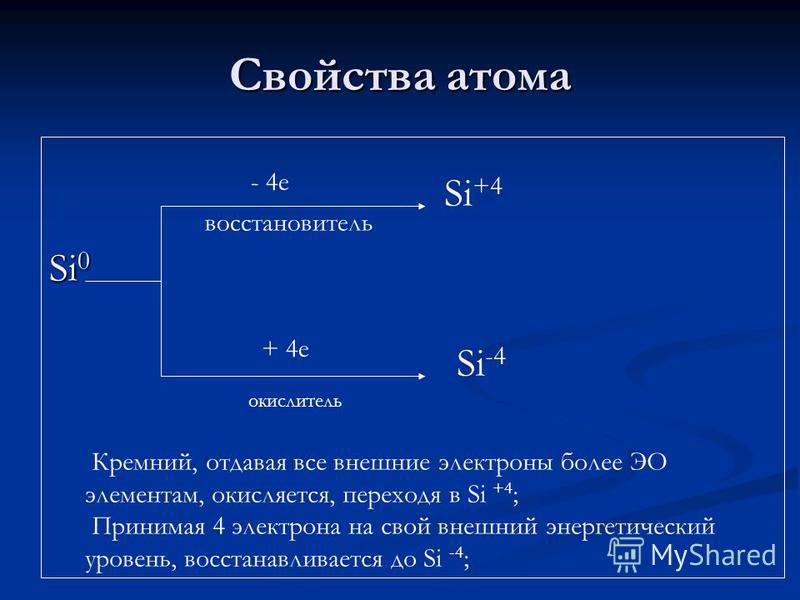
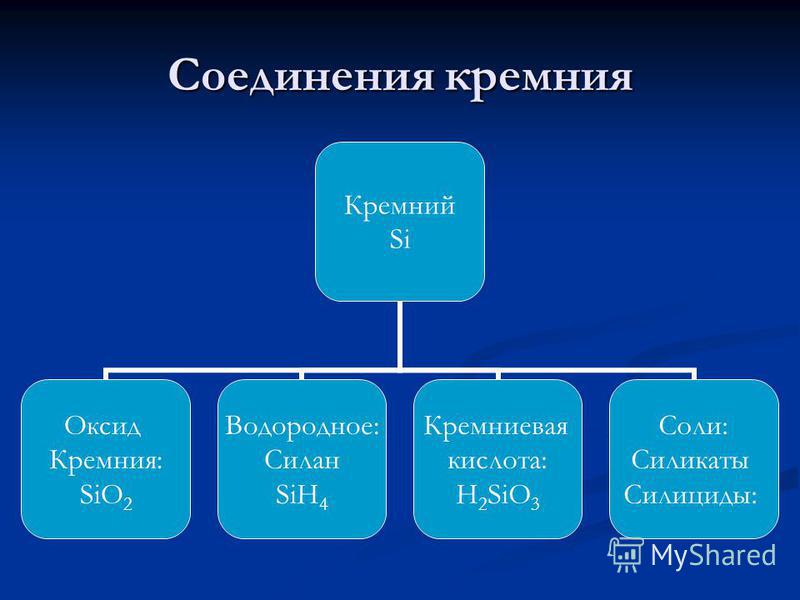
Ատոմային հատկություններ Si e կրճատող նյութ + 4 e oxidizer Si + 4 Si -4 Silicon, տալով բոլոր արտաքին էլեկտրոնները ավելի EO տարրեր, օքսիդացված, անցնելով Si + 4; Արտաքին էներգիայի մակարդակով 4 էլեկտրոն ընդունելու դեպքում այն կրճատվում է Si-4;

Սիլիկոնային սիլիկոնի ֆիզիկական հատկությունները ոչ մետաղական են, այն գոյություն ունի բյուրեղային եւ ամորֆ վիճակում: Բյուրեղային սիլիկոն է մոխրագույն պողպատե նյութ, որը մետաղյա փայլ է, շատ դժվար, բայց փխրուն: Ամորֆ սիլիկոն - շագանակագույն փոշի: p = 2.33 գ / սմ 3; t pl. = C; t kip. = C;

Սիլիկոնի բյուրեղյա կառուցվածքը Silicon- ի բյուրեղապակյա խառնուրդը խորքային դեմքի կենտրոնացված ալմաստի տեսակ է: Սակայն Si - Si- ի միջեւ երկար կապի երկարության շնորհիվ սիլիցիի կարծրությունը զգալիորեն պակաս է, քան ադամանդը: Silicon- ն փխրուն է միայն այն դեպքում, երբ ջերմաստիճանը բարձր է:

Էլեկտրաֆիզիկական հատկություններ Elemental silicon Elemental silicon- ը սովորական կիսահաղորդիչ է: սովորական կիսահաղորդիչ: Բյուրեղային սիլիկոնային էլեկտրաֆիզիկական հատկությունները մեծապես ազդում են դրա մեջ պարունակվող հետքերին: Սիլիկոնային բյուրեղների ձեռք բերելու համար անցքային հաղորդակցությամբ, 3-րդ խմբի բորերի, ալյումինի, գալլիի եւ ինդիի տարրերի հավելումներ են տեղադրվում սիլիկոնում `ֆոսֆորի, մկնդեղի կամ ձուլման 5-րդ խմբի տարրերի էլեկտրոնային փոխանցման միջոցով:


Flint Flint, այս Flint- ը, այս տգեղ եւ շատ տգեղ ու շատ ամուր քարի, ամուր քար, հիմք դարձրեց քարե դարաշրջանի քարե դարաշրջանի հիմքը `դարի - ճեղքի աշխատանքային գործիքների դար: շերեփային գործիքներ: Երկու պատճառ կա. - սիլիկոնի տարածվածությունը եւ հասանելիությունը. - սիլիկոնի տարածվածությունը եւ հասանելիությունը; - կտրված կտրված ծայրերը ձեւավորելու ունակությունը. - կտրված կտրված ծայրերը ձեւավորելու ունակությունը.




Գիտեք, որ .. Սիլիցիումի մաքուր ձեւով ձեռք բերելու մեթոդը մշակվել է Նիկոլայ Նիկոլաեւիչ Բետետովի կողմից: Ռուսաստանում սիլիկոն արտադրվում է գործարաններում `Կամենս - Ուրալսկի (Սվերդլովսկի մարզ): Կամենս - Ուրալսկի (Սվերդլովսկի մարզ) Շլեխհ (Իրկուտսկի մարզ): Շեյխ (Իրկուտսկի շրջան):

Սիլիցիումի արտադրությունը Արդյունաբերությունում սիլիկոնն առաջացնում է SiO 2- ի հալվածքը կոլոկի միջոցով, t = C- ում, դարերում: Այսպիսով ձեռք բերված սիլիկոնի մաքրությունը 99.9% է:
Սիլիկոնային լաբորատոր արտադրության մեթոդի ձեռքբերում. SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Սիլիցիումի քիմիական հատկությունները `մինչեւ 400 ° C տաքացվող, սիլիկոնն արձագանքում է թթվածին` սիլիկոնային երկօքսիդ ստեղծելու համար. Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
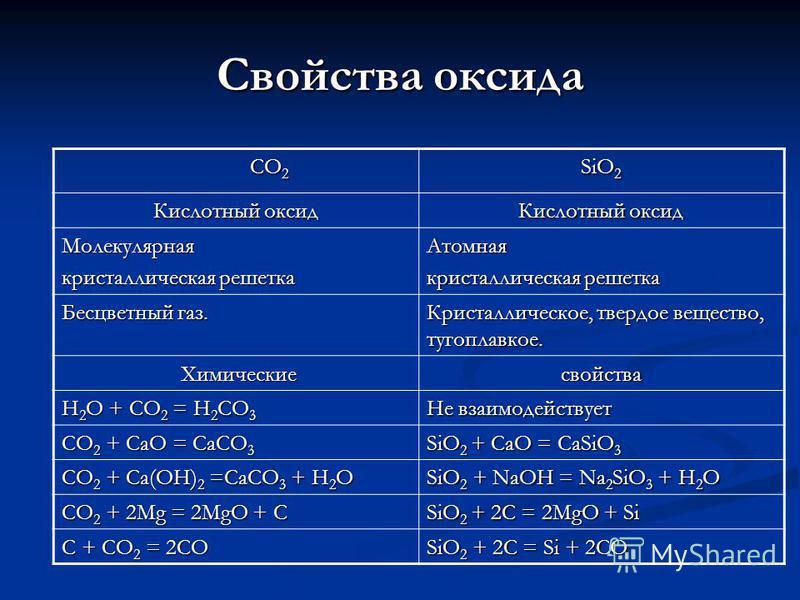
CO 2 CO 2 ՍԻՈ 2 օքսիդի հատկություններ Թթվային օքսիդ Մոլեկուլային բյուրեղյա վանդակ Atomic Colorless գազ: Բյուրեղային, կոշտ, հուսալի: Քիմիական քիմիական հատկություններ H 2 O + CO 2 = H 2 CO 3 Չի արձագանքում CO 2 + CaO = CaCO 3 SiO 2 + CaO = CaSiO 3 CO 2 + Ca (OH) 2 = CaCO 3 + H 2 O SiO 2 + NaOH = Na 2 SiO 3 + H 2 O CO 2 + 2Mg = 2MgO + C SiO 2 + 2C = 2MgO + Si C + CO 2 = 2CO SiO 2 + 2C = Si + 2CO
Թթուների հատկությունները H 2 CO 3 H 2 SiO 3 Dibasic, թթվածին պարունակող, թույլ, փխրուն, քանի որ թռչող. Dibasic, թթվածին պարունակող, թույլ, լուծելի ջրի մեջ: Ստանալով `CO 2 + H 2 O = H 2 CO 3 Ստացող: SiO 2 + H 2 O = չի կարող անկայուն, փխրուն, decomposes, երբ կանգնած կամ ջեռուցվում H 2 CO 3 = CO 2 + H 2 O Չի կարելի ընտրվել իր մաքուր ձեւով, քանի որ decomposes, երբ ջեռուցվում: H 2 SiO 3 = SiO 2 + H 2 O Zn + H 2 CO 3 = ZnCO 3 + H 2 Փոքր գազի էվոլյուցիան __________

Silicic Acid Carbonic Acids - Carbonates; - ածխաջրածիններ; - սիլիկատներ; - սիլիկատներ; Կարբոնատները ունեն աղի բոլոր հատկությունները, ուժեղ էլեկտրոլիտներ են, լիովին տարբերվում են իոնների մեջ (լուծելի ջրի մեջ): Միայն ալկալային մետաղական աղերը լուծելի են, մյուսներն էլ լուծելի չեն կամ չեն կազմում աղեր (Al +3, Cr +3, Ag +):
![]()



Կենսաբանական դերը Կարեւորագույն սիլիկոնային բաղադրությունը, SiO 2, կարեւոր է բույսերի եւ կենդանիների կյանքի համար: Շնորհիվ նրան, ռեպրեսիաները, խառնաշփոթները Շնորհակալ ենք նրան, խարույկներին, գմբեթներին եւ ձիավորներին, որոնք ամրացնում են սվինները: եւ horsetails կանգնած են ամուր, ինչպես սվիններ. Sharp sedge տերեւները կտրված են ինչպես Sharp sedge- ի տերեւները, այնպես էլ դանակներով կտրված, ցանված դաշտային դանակների վրա փաթաթան, խռխռված դաշտի վրա փաթաթան, ասեղի պես, եւ ասեղների պես կծկված հացահատիկի կեռները, եւ հացահատիկի կեռները այնքան ուժեղ են, որ թույլ չեն տալիս, որ թույլ չտալ, որ դաշտը դաշտերում ընկնի անձրեւից եւ քամու դաշտը դաշտերում, որպեսզի անցնեն անձրեւից ու քամուց


Սիլիկոնն այն մեսիջ է, որը մշտապես պարունակում է մարդու մարմնում: Դրա մեծամասնությունը պարունակում է ավշային հանգույցների, աորտայի միակցիչ հյուսվածքի, քրտնարտադրության, մազերի եւ մաշկի մեջ: Սիլիկոնային անհրաժեշտ է կառուցել էպիթելային բջիջներ: Սիլիկոնն այն մեսիջ է, որը մշտապես պարունակում է մարդու մարմնում: Դրա մեծամասնությունը պարունակում է ավշային հանգույցների, աորտայի միակցիչ հյուսվածքի, քրտնարտադրության, մազերի եւ մաշկի մեջ: Սիլիկոնային անհրաժեշտ է կառուցել էպիթելային բջիջներ: Silicon- ն կարեւոր դեր է խաղում ոսկրային հանքայնացման գործընթացում, անհրաժեշտ է պահպանել արմատային պատի առաձգականությունը, դրական ազդեցություն ունի իմունային համակարգի վրա եւ դանդաղեցնում է ծերացման գործընթացը մարդու մարմնի հյուսվածքներում: Արյան մեջ սիլիկոնի միջին պարունակությունը կազմում է 8.25 մգ / օր: Տարիքով, մարմնի մակարդակը նվազում է, ուստի տարեց մարդկանց մեջ սիլիկոնային անհրաժեշտությունը աճում է: Բարելավել սիլիկոնի կլանումը մարմնի կողմից կալցիումի, մագնեզիումի, մանգանի եւ կալիումի ներկայությունը: Silicon- ն կարեւոր դեր է խաղում ոսկրային հանքայնացման գործընթացում, անհրաժեշտ է պահպանել արմատային պատի առաձգականությունը, դրական ազդեցություն ունի իմունային համակարգի վրա եւ դանդաղեցնում է ծերացման գործընթացը մարդու մարմնի հյուսվածքներում: Արյան մեջ սիլիկոնի միջին պարունակությունը կազմում է 8.25 մգ / օր: Տարիքով, մարմնի մակարդակը նվազում է, ուստի տարեց մարդկանց մեջ սիլիկոնային անհրաժեշտությունը աճում է: Բարելավել սիլիկոնի կլանումը մարմնի կողմից կալցիումի, մագնեզիումի, մանգանի եւ կալիումի ներկայությունը:

Սիլիկոնային կենսաբանական դերը ներառում է նաեւ ցածր կենդանի օրգանիզմների բաղադրամասերում `դիատոմներ եւ ռադիոակտիվներ, որոնք ստեղծում են կենդանի նյութի առավել նուրբ լույսերը, որոնք ստեղծում են սիլիկայից պատրաստված անգերազանցելի գեղեցկություն կմախքներ: Սիլիկոնը նաեւ ցածր կենդանի օրգանիզմների մի մասն է. Diatoms եւ ռադիոլրաբանները `կենդանի նյութի առավել նուրբ լույսերը, որոնք ստեղծում են անթերի սիլիկյան կմախքներ: Diatoms Radiolaria Self- վերահսկողություն 1. Ինչ է սիլիցիում տեղը պարբերական համակարգում. Ա) 2-րդ, 4-ը: բ) 3 ժամ, 3 գր: գլխում: գ) 3 փուլ, 4 գր: գլուխ) 2 ժամանակահատված, 4 գր. բ) 3 ժամ, 3 գր: գլխում: գ) 3 փուլ, 4 գր: գլխում: 2. Սիլիկոնային վանդակ `ա) ionic; բ) ատոմային; գ) մոլեկուլային; ա) իոնիկ; բ) ատոմային; գ) մոլեկուլային; 3. Ըստ սիլիկոնի բնույթի տարածվածության, ... տարր. ա) նախ; բ) երկրորդը. գ) երրորդը. ա) առաջինը. բ) երկրորդը. գ) երրորդը. 4. Սիլիկոնն արձագանքում է `ա) մետաղները, ջրածինը, հալոգենները; ա) մետաղները, ջրածինը, հալոգենները; բ) մետաղներ, հալոգեններ, հեշտ լուծվող ալկալաներում; բ) մետաղներ, հալոգեններ, հեշտ լուծվող ալկալաներում; գ) օքսիդներ, թթուներ, ոչ մետաղներ: գ) օքսիդներ, թթուներ, ոչ մետաղներ: 5. Silicic acid աղեր `ա) սիլիցիդներ. բ) hydrosilicates; գ) սիլիկատներ; ա) սիլիցիդներ. բ) hydrosilicates; գ) սիլիկատներ;

Սիլիկոն:
Սիլիկոն - Քիմիական տարրերի պարբերական համակարգի 3-րդ շրջանի խմբի IV հիմնական ենթախմբի բաղադրիչ, Դ.Ի. Մենդելեեւ, ատոմային 14-ը, ատոմային զանգվածը `28.0855. Բաղադրիչների մեջ սովորաբար պարունակում է +4 (valence IV) եւ շատ հազվադեպ +3, +2 եւ +1 (valences, համապատասխանաբար, III, II եւ I) օքսիդացում: Պարբերական աղյուսակում Mendeleev silicon- ը գտնվում է IVA խմբի մեջ (A- նշում է, որ դա հիմնական ենթախումբն է) (ածխածնի խմբում), երրորդ ժամանակահատվածում: Nemetall . Նշված խորհրդանիշով Si(լատ Սիլիկոնիում): Ազատ ձեւով `շագանակագույն փոշի կամ թեթեւ գորշ կոմպակտ նյութ, մետաղական փայլով: Կտրուկի կառուցվածքը. խորանարդ, ադամանդ:
Հիմնական պետություն 14 Si 14 ե 1s 2 2s 2 2p 6 3s 2 3p 2, p-element.
2. Ֆիզիկական հատկություններ:
Բյուրեղային սիլիկոն մոխրագույն մոխրագույն նյութ է `պողպատե փայլով: Սիլիկոնի կառուցվածքը նման է ադամանդի կառուցվածքին: Իր բյուրեղյա յուրաքանչյուր ատոմը շրջապատված է չորս այլ թիթեղներով եւ կապված է նրանց հետ, որոնք կապում են կապիտալ կապով, ինչը շատ ավելի թույլ է, քան ածխածնի ածխածնի միջեւ: Սիլիկոնային բյուրեղներում, նույնիսկ նորմալ պայմաններում, կովինալենտային կապերից որոշները ոչնչացվում են: Հետեւաբար, այն ունի ազատ էլեկտրոններ, որոնք առաջացնում են փոքր էլեկտրական հաղորդակցություն: Երբ լուսավորումը եւ ջեռուցումն ավելանում են կոտրված կապերի քանակը, ինչը նշանակում է, որ ազատ էլեկտրոնների քանակն ավելանում է, եւ էլեկտրական հաղորդունակությունը մեծանում է: Այսպիսով, պետք է բացատրի սիլիկոնի կիսահաղորդչային հատկությունները:
Սիլիկոնը շատ փխրուն է, դրա խտությունը 2.33 գ / սմ3 է: Ածուխի նման, վերաբերում է հրակայուն նյութերին:
Սիլիկոնը բաղկացած է երեք կայուն izotopes: 2814Si (92.27%), 2914Si (4.68%) եւ 3014Si (3.05%):
3. Լինելով բնության մեջ:
Շատ հաճախ բնույթով սիլիկոն է հայտնաբերվում silica - բաղադրիչներ, որոնք հիմնված են սիլիկոնային երկօքսիդի (IV) SiO2- ի վրա (մոտավորապես 12% - ով `երկրի խառնուրդի զանգվածի): Սիլիկոնային երկօքսիդի կողմից ձեւավորված հիմնական հանքանյութերը եւ ժայռերը ավազ (գետ եւ քվարց), քվարց եւ քվարցիտ, ճեղքվածք եւ շերտափար: Բնական սիլիկատները ունեն բարդ կազմ եւ կառուցվածք: Ահա որոշ բնական սիլիկատների կազմը.
ü feldspar K 2 O × Al 2 O 3 × 6SiO 2,
Asbestos 3MgO × 2SiO 2 × 2H 2 O,
ü mica K 2 O × 3Al 2 O 3 × 6SiO 2 × 2H 2 O,
ü kaolinite 3Al 2 O 3 × 2SiO 2 × 2H 2 O.
Սիլիկոնային միացությունների բնույթով երկրորդ ամենատարածված խումբն է սիլիկատներ եւ ալյումինոսիկատներ
Նշենք, որ մաքուր սիլիկոն հայտնաբերելու առանձին փաստեր մայրենի լեզվով են:
4. Սիլիկոնի եւ դրա միացությունների քիմիական հատկությունները:
Քիմիական հատկություններով, սիլիկոն, ինչպես ածխածնի նման, ոչ մետաղական է, սակայն նրա ոչ մետաղականությունը պակաս արտահայտված է, քանի որ այն ունի ավելի մեծ ատոմային շառավղ: Քանի որ սիլիկոնային ատոմները ունեն 4 էլեկտրոններ արտաքին էներգետիկ մակարդակով, երկուսն էլ -4 եւ +4 օքսիդացման վիճակն առանձնանում է սիլիկոնին (հայտնի է որպես սիլիցիումի բալոն, որտեղ օքսիդացման աստիճանը +2 է):
Նորմալ պայմաններում սիլիկոնն ավելի իներտ է, որը պետք է բացատրվի իր բյուրեղյա ցանցի ուժով: Այն ուղղակիորեն շփվում է միայն ֆտորին:
Թթուներ (բացառությամբ հիդրոֆլուորային HF եւ ազոտի HNO 3 խառնուրդ)սիլիկոն չի գործում: Այնուամենայնիվ, այն լուծարվում է ալկալիային մետաղի հիդրոքսիդներով, կազմելով սիլիկատ եւ ջրածնի.
Սիլիկոնի, բյուրեղային եւ ամորֆի երկու ալոտրոպային փոփոխությունների մասին, ամորֆային սիլիկոնն ավելի քիմիական ակտիվ է: Նա արձագանքում է թթվածինը երբ ջեռուցվում է, կազմելով SiO 2:
ինչպես նաեւ բոլորի հետ հալոգեններօրինակ `
![]()
Բարձր ջերմաստիճանում սիլիկոն կապում է ածխածնի հետկազմելով կարբորունդի SiC:
Carborundum- ն ունի ալմաստի նման բյուրեղյա վանդակ, որի մեջ յուրաքանչյուր սիլիկոնային ատոմը շրջապատված է չորս ածխածնի ատոմով եւ հակառակը, եւ կապույտ կապերը շատ ուժեղ են, ինչպես ադամանդը: Հետեւաբար, կարծրության մեջ այն մոտ է ադամանդին: Խառնուրդ քարերը եւ սալահատակները պատրաստվում են սիլիկոնային կարբիդից:
Մագնեզիումի սիլիցիդ: Ակտիվ մետաղների հետ կապված ռեակցիաներում, որոնք ձեւավորվում են ձեւավորմամբ սիլիցիդներ, Silicon- ը հանդես է գալիս որպես օքսիդացող նյութ:
Բարձր ջերմաստիճանի դեպքում սիլիկոնները վերականգնում են բազմաթիվ մետաղներ իրենց օքսիդներից (!!!)
Սիլան Սիլիցիդների վրա հիդրոքլորիդային թթվի գործողության արդյունքում սիլիկոնի ամենապարզ ջրածնի բաղադրությունը սիլան SiH 4:
Silane- ը թունավոր գազ է, որը տհաճ հոտով է, օդում ինքնատիպ է (!!!):
Սիլիկոնային օքսիդ (IV):Սիլիկոնային օքսիդ (IV) կոչվում է նաեւ silica. Դա կոշտ հրատապ նյութ է: (հալման կետ) 1700 ° C) տարածված բնույթով `երկու ձեւով.
1) բյուրեղային սիլիկատ - քվարցի հանքանյութի եւ դրա տեսակների (ռոք բյուրեղյա, քալկեդոն, ագատ, ջասեր, շերտ) ձեւով; քվարցը ձեւավորում է շինարարության եւ սիլիկատային արդյունաբերության մեջ լայնորեն կիրառվող քվարցային ավազի հիմքը,
2) ամորֆային սիլիցիում - օպալային հանքային կազմի ձեւով SiO 2 × n H 2 O; ամորֆային սիլիկայի հողային ձեւերը դիատոմիտ են, եռափուլին (infusorial earth); Արհեստական ամորֆ անջուր սիլիկայի օրինակ է սիլիկատային գել, որը ստացվում է նատրիումի մետազիլիկատից.
Silica գել ունի զարգացած մակերեւույթ եւ, հետեւաբար, ներծծում է խոնավությունը: .
1710 ° -ում քվարցը հալեցնում է. Ձուլված զանգվածի արագ սառեցմամբ ձեւավորվում է քվարցային ապակի . Այն ունի շատ ցածր ընդլայնման գործակից, որպեսզի տաք կվարցային ապակիները չեն փչում, երբ ջուրը արագ սառեցվում է: Լաբորատոր ապակյա արտադրանք եւ գործիքներ գիտական հետազոտությունների համար պատրաստվում են քվարցային ապակուց:
Սիլիկոնային օքսիդի (IV) SO 2- ի պարզագույն բանաձեւը նման է ածխածնի երկօքսիդի (IV) CO 2- ի բանաձեւին: Մինչդեռ նրանց ֆիզիկական հատկությունները շատ տարբեր են (SiO 2 - պինդ, CO 2 - գազ): Այս տարբերությունը բացատրվում է բյուրեղապակյա ցանցերի կառուցվածքով: C0 2 բյուրեղացնում է մոլեկուլային ցանցում, SiO 2 - ատոմում: SiO 2- ի կառուցվածքը պատված պատկերով կարող է ներկայացվել հետեւյալ կերպ.
Ածխածնի CO 2- ի կոորդինացիոն թիվը 2 է, իսկ SiO 2- ի սիլիկոնը `4: 4. Յուրաքանչյուր սիլիկոնային ատոմ ներգրավված է 4 թթվածնային ատոմում: Միեւնույն ժամանակ, սիլիկոնային ատոմը գտնվում է կենտրոնում, եւ թթվածնային ատոմները տեղակայված են թեքրադրոնի գագաթներով . Սիլիկայի ամբողջ կտորը կարելի է համարել որպես բյուրեղյա, որի բանաձեւը (SiO 2) n է: Սիլիկոնային օքսիդի (IV) այս կառուցվածքը սահմանում է բարձր կոշտության եւ refractoriness- ը .
Սիլիկոնային օքսիդի (IV) SiO 2- ի քիմիական հատկությունները վերաբերում են թթվային օքսիդներին: Երբ խառնվում են պինդ alkalis, հիմնական օքսիդները եւ կարբոնատները, ձեւավորվում են սիլիկոնաթթուների աղեր.
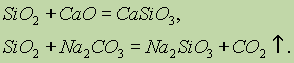
Միայն հիդրոֆուրային թթու փոխազդեցությունը սիլիկոնային օքսիդով (IV):
Այս արձագանքը օգտագործվում է աղեղի ապակիների համար: .
Սիլիկոն (IV) ջրի մեջ չի լուծվում եւ քիմիապես չի փոխազդում դրա հետ (!!!) Հետեւաբար, սիլիկոնաթթուը անուղղակի կերպով ձեռք է բերվում կալիումի կամ նատրիումի սիլիկատի լուծույթի վրա `
Այս դեպքում silicic թթու (կախված նախնական կենտրոնացումը աղ եւ թթու լուծումների) կարող է ձեռք բերել ձեւով դոնդողանման զանգվածային պարունակում է ջրի, եւ այն ձեւով, որը colloidal լուծույթով (sol):
Սիլիկոնաթթու: SiO 2- ը մի շարք սիլիկիկ թթուների անխիդրիտ է, որի կազմը կարելի է արտահայտել ընդհանուր բանաձեւով `xSiO 2 × yH 2 O, որտեղ x եւ y - integers:
1) x = 1, y = 1 `SiO 2 × H 2 O, այսինքն H 2 SiO 3 - metasilicic թթու;
2) x = 1, y = 2: SiO 2 × 2H 2 O, այսինքն H 4 SiO 4 - orthosilicic թթու;
3) x = 2, y = 1: 2SiO 2 × H 2 O, այսինքն H 2 Si 2 O 5 - bimetacrynic թթու.
Silicic acid- ը կառուցված է եռանկյունային կառուցվածքային ստորաբաժանումներից (յուրաքանչյուր բաղադրամասում, սիլիկոնային ատոմը գտնվում է տտութեդրոնի կենտրոնում, եւ գլխավերեւում թթվածինային ատոմներ են): Շղթաներով միավորող կառուցվածքային կապերը ավելի կայուն պոլիսիլիկոնային թթուներ են կազմում.
Նման միացությունների կազմը կարող է արտահայտվել բանաձեւով (H 2 SiO 3) n: Այնուամենայնիվ, սովորաբար սիլիկոնաթթուը ներկայացնում է H 2 SiO 3 բանաձեւը: H 2 SiO 3 - թթվային շատ թույլ է, ջրի փոքր լուծելի: Երբ ջեռուցվում է հեշտությամբ տարբերվում է ածխաթթուների նման:
Բոլոր սիլիկիկ թթուները շատ թույլ են (ավելի յուղից):
Սիլիկատներ: Բոլոր silicic թթուների աղերը կոչվում ենսիլիկատներ, չնայած, որպես կանոն, կրթական գրականության մեջ սիլիկատները ենթադրում են մեթախական թթուների աղեր: Նրանց կազմը սովորաբար ներկայացվում է բանաձեւով `տարրերի օքսիդների միացությունների տեսքով: Օրինակ, CaSiO 3 կալցիումի սիլիկատը կարող է արտահայտվել որպես CaO × SiO 2:
R 2 O × nSiO 2 բաղադրամասի սիլիկատներ, որտեղ R 2 O - նատրիումի կամ կալիումի օքսիդներ , կոչվում են լուծվող ապակիներ , ա դրանց կենտրոնացված ջրային լուծումներ - հեղուկ ապակի . Նատրիումի սոդա ապակին ամենակարեւորն է:.
Օդի մեջ կանգնած ժամանակ սիլիկատների լուծումները աճում են, քանի որ օդի ածխաթթու գազը (IV) օդում տեղադրում է իր սիլիցիաթթուն:
Silicic acid- ը գրեթե անլուծելի է ջրի մեջ, այս հատկությունը օգտագործվում է որպես որակական ռեակցիա ion SiO 3 2-
Սիլիկատներ ստացվում են ալկալիների կամ կարբոնատների հետ սիլիցիայով միկրոֆոնով.
5. Իոնների SiO 3-ի հայտնաբերում 2. (Ես չեմ կարող գտնել որեւէ բան ...)
6. Սիլիկոնային միացությունների դերը հողի ձեւավորման եւ անտառային տնտեսության մեջ:
Վնասված ժայռերը բավականին կայուն են իրենց կազմի մեջ եւ պարունակում են հիմնականում սիլիցիումի, ալյումինի, երկաթի, ալկալիների, մագնեզիումի եւ կալցիումի միացություններ: Si0 2 բովանդակության համաձայն, աղբի ժայռերը բաժանված են չորս խմբերի `acidic (\u003e 65%), medium (52-65%), հիմնական (40-52%) եւ ultrabasic<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Թթունային ժայռեր- granites, pegmatites, rhyolites, dacite եւ այլն, սովորաբար ունենում են թեթեւ եւ դարչնագույն գույն, ականապատված բյուրեղների, շաքարավազի, մկների հետ: SiO 2 պարունակությունը նրանց մեջ բարձր է (ավելի քան 65%), զգալի քանակությամբ կալիումի եւ նատրիումի: Միեւնույն ժամանակ, քիչ երկաթ է, եւ կալցիումի եւ մագնեզիումը աննշան են: Թթվածային հանքային ժայռերի վրա, օրինակ, գրանիտների վրա հողերը տարբերվում են աղբյուրի նյութի մանրախիճ բնույթով, եղանակի արտանետման վաղ փուլերում: Նվազագույն պայմաններում եղած ժամանակ, նրանք հեշտությամբ կկորցնեն ալկալային-երկրային տարրերը, որոնց արդյունքում նման աղտոտված հողերի վրա հողը (ժայռերի էլյուվիում) չափազանց աղքատ է, վատ բեղմնավոր:
Հիմնական ժայռոտ ժայռերը `բազալտ, գաբրո եւ այլն, որպես կանոն, ունեն մուգ (սեւ) գույն: Նրանք բնութագրվում են ստորին SiO 2 բովանդակությամբ, համեմատած acidic ժայռերի հետ: Հիմնական հրաբխային ժայռերը համեմատաբար հարուստ են երկաթի, մանգանի, քրոմի, կոբալտի, ցինկի, տիտանի, նիկելի, պղնձի միացությունների մեջ: Նրանց արտահոսքի արտադրանքը բավականին արագ է ձեռք բերում կավային բնույթ, երկար ժամանակ պահպանում է ալկալային եւ չեզոք արձագանք եւ առանձնանում են հումուսի եւ կավե հանքանյութերի մեծ քանակությամբ: Նման ժայռերի վրա հողը ավելի բերրի է:
Բացի acidic եւ հիմնական տեսակների հաճախ հայտնաբերված են անցողիկ տիպի հանքային ժայռեր(միջին) - դիորիտային խմբի ինտրուզային ժայռերը եւ դրանց ազդեցիկ գործընկերներն ունդիտները: Հետեւաբար, այդ ժայռերի վրա հողերը ձեռք են բերում այնպիսի հատկություններ, որոնք նման են acidic կամ հիմնական ժայռերին: Շատ քիչ ընդհանուր է Ուլտրամանուշակագույն breeds:պրիդոտիտները եւ picrites, որոնք ունեն ամենացածր SiO 2 բովանդակությունը:
Մետամորֆիկ ժայռեր -անցումային շրջանում զանգվածային բյուրեղային եւ նստվածքային ժայռերի միջեւ: Ձկնորսության տակ գտնվող հինավուրց նստվածքները, բարձր ճնշումը եւ ջերմաստիճանը մետամորֆոզված են, ձեւավորելով gneisses, serpentinites, marble, quartzites, slabs: Gneisses- ը հատկապես նման է գրանիտների կազմի: Նման ժայռերի վրա կազմված հողերը նմանատիպ առանձնահատկություններ ունեն հողի մեջ, թթվածային ժայծոտ ժայռերի վրա:
Քլոր:
1. Դի Մենդելեւի սեղանի մեջ ալյումինի դիրքերը: Ատամի կառուցվածքը, օքսիդացման դրսեւորման աստիճանը:
Քլոր - VII խմբի հիմնական ենթախմբի տարրը, 3-րդ շրջանը, ատոմային թիվ 17-ը: Այն նշվում է C1- ի խորհրդանիշով (Chlorum): Քիմիական ակտիվ ոչ մետաղական . Ներառված է հալոգեն խմբի մեջ .
Պարզ նյութը քլորի նորմալ պայմաններում - թունավոր գազի դեղնավուն-կանաչ գույնը ծանր է, քան օդը, ուժեղ հոտով . Diatomic քլորի մոլեկուլը (բանաձեւը Cl 2):
Հիմնական պետություն `+17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-element. Արտ. -1 +1 +3 +5 +7.
Էլեկտրոնային շերտերի կառուցվածքը:
Քլորի ատոմի վալենսի մակարդակում պարունակում է 1 անհայտ էլեկտրոն : 1s 2 2s 2 2p 6 3s 2 3p 5, այնպես որ քլորի ատոմի համար 1 արժեքը շատ կայուն է: Քլորային ատոմի քլորային ատոմի ներկայության շնորհիվ քլորի ատոմը կարող է ցուցաբերել օքսիդացման այլ աստիճաններ: Ատոմի հուզված պետությունների ձեւավորման սխեմա.
Քլորի միացությունները հայտնի են նաեւ այն ժամանակ, երբ քլորի ատոմը պաշտոնապես ներկայացվում է 4 եւ 6 վալենսներ, օրինակ, ClO 2 եւ Cl 2 O 6: Այնուամենայնիվ, այդ միացությունները արմատական են, այսինքն, ունենում են մեկ անհավանական էլեկտրոն:
2. Ֆիզիկական հատկություններ:
Նորմալ պայմաններում քլորը դեղին-կանաչ գազ է, որը տհաճ հոտով է: Որոշ ֆիզիկական հատկություններ ներկայացված են ստորեւ:
Խտություն `3.214 գ / լ, լիգա - -35 ° C - 1.557, հեռուստացույց: -105 0 С- 1,9 գ / սմ 3:
Հալման կետ `172.2 Կ
Եռման կետ `238.6 Կ
Ջերմաստիճանի ջերմություն. 6.41 կ / ժ
Գոլորշիության ջերմաստիճանը `20.41 կ / ժ:
Քլոր գազը համեմատաբար հեշտ է հեղուկացնել: 0.8 ՄՊա (8 մթնոլորտ) ճնշման սկզբից սկսած, քլորը հեղուկ կլինի արդեն սենյակային ջերմաստիճանում: Երբ սառեցվում է -34 ° C ջերմաստիճանում, քլորը նույնպես հեղուկ է դառնում նորմալ մթնոլորտային ճնշման ժամանակ: Հեղուկ քլորի դեղին-կանաչ հեղուկը շատ բարձր քայքայիչ ազդեցություն ունի (մոլեկուլների բարձր կոնցենտրացիայի շնորհիվ): Ճնշումը մեծացնելով, Դուք կարող եք հասնել հեղուկ քլորի գոյությանը +144 ° C ջերմաստիճանի (ջերմային ջերմաստիճանի) 7.6 ՄՊա կրիտիկական ճնշման ժամանակ: Էլեկտրական հաղորդակցության առումով հեղուկ քլորը տեղի է ունենում ամենաուժեղ մեկուսիչների շրջանում, որն իրականացնում է գրեթե մեկ միլիարդ անգամ ավելի ցածր ջուր, քան արծաթը, 10 22 անգամ ավելի վատ: Քլորում ձայնի արագությունը մոտ մեկուկես անգամ պակաս է, քան օդում:
3. Լինելով բնության մեջ:
Բնության մեջ կա երկու կլանների 35 CI եւ 37 CI isotopes: Քլորը երկրագնդի ամենատարածված հալոգենն է: . Քլորը շատ ակտիվ է - այն ուղղակիորեն կապում է պարբերական համակարգի գրեթե բոլոր տարրերի հետ: Հետեւաբար, բնության մեջ այն հայտնաբերվում է հանքանյութերի կազմի մեջ միայն միացությունների տեսքով.
ü Halite NaCl,
ü sylvina KCl,
ü sylvinite KCl · NaCl,
ü bischofite MgCl 2 · 6H 2 O,
ü carnallite KCl · MgCl 2 · 6H 2 O,
ü Cainite KCl · MgSO 4 · 3H 2 O.
Խլոնի ամենամեծ պաշարները պարունակում են աղում, ջրերում, ծովերում եւ օվկիանոսներում (ծովային ջրերում պարունակությունը 19 գ / լ է): Քլորինը կազմում է երկրի ընդերքում ընդհանուր քանակի ատոմների 0,024% -ը: clarke համարը (թվերը, որոնք արտահայտում են երկրի խառնուրդի քիմիական տարրերի, հիդրոերկրեայի, Երկրի, տիեզերական մարմինների, աշխարհաքիմիական կամ քոսմոքիմիական համակարգերի միջին պարունակությունը, այս համակարգի ընդհանուր զանգվածի նկատմամբ, արտահայտված% կամ g / կգ): քլորինը `0.017%: Մարդու մարմինը պարունակում է 0.25% քլորի իոններ քաշով: Մարդկանց եւ կենդանիների մեջ քլորը հիմնականում գտնվում է միջերկրուկային հեղուկների (այդ թվում `արյան մեջ) եւ կարեւոր դերակատարում է osmotic գործընթացների կարգավորման մեջ, ինչպես նաեւ նյարդային բջիջների աշխատանքի հետ կապված գործընթացներում:
4. Քլորի քիմիական հատկությունները եւ դրանց միացությունները: Ձեռք քլորի:
Սիլիկոնային ատոմի կառուցվածքը: Si. +14. Հուզված պետություն: E. 3d. 3p. 3s. E. 3d. 3p. 3s. 1s 2s 2p 3s 3p: 2e 8e 4e. 2. 2. 2. 2. 2.
«Սիլիկոն» ներկայացման նկարը, քիմիայի դասերը «սիլիկոն» թեմայովՉափերը `960 x 720 փիքսել, ֆորմատ: jpg: Քիմիա դասի համար անվճար պատկեր ներբեռնելու համար պատկերի վրա սեղմեք աջ եւ սեղմեք «Պահել պատկերը որպես ...»: Դասում նկարները ցույց տալու համար դուք նաեւ կարող եք ներբեռնել «Silicon.ppt» - ի շնորհանդեսը անվճար `բոլոր արխիվների մեջ: Արխիվի չափը `562 KB:
Ներբեռնման ներկայացումՍիլիկոն
«Սիլիկոն եւ դրա միացությունները» - ատոմների կառուցվածքն ու հատկությունները: Կիսահաղորդիչ: t melt (Si) = 1415? C, t melt (ադամանդ) = 3730? Ստանալով սիլիկոն: Սիլիկոնի հայտնաբերումը: Ներառում է նաեւ բույսերի եւ կենդանիների կազմը: Սիլիկոնի ֆիզիկական հատկությունները: Այսպիսով, աղյուսը կերամիկա է, եւ հին հունական ամֆորայի սալիկները եւ դրվագները նաեւ կերամիկա են: Նպատակը. Սիլիկոնի քիմիական հատկությունները:
«Սիլիկոնային միացություններ» - Սիլիկոն եւ դրա միացությունները: SiO2- ի քիմիական հատկությունները: Սիլան Սիլիկիկ թթու ստացում: Սիլիկոնային հատկություններ: Սիլիկոնային օքսիդ: Բնական սիլիկատներ: Օքսիդացման վիճակ Rhinestone Տոպազ. Սիլիկոն ստանալ լաբորատորիայում: Լինելով բնության մեջ: Բյուրեղյա վանդակաճաղեր: Սիլիկոնի հայտնաբերումը: Ամեթիստ: Ստանալով սիլիկոն:
«Սիլիկոնային իզոտոպներ» - Սիլիկոնային իզոտոպների բաժանում: Polycrystalline silicon- ի արտադրությունը: Մոնոիզոտոպիկ սիլիկոնի օգտագործման հեռանկարները: Ցիկլով կեղեւից մեկ բյուրեղի աճեցման ժամանակ изотопические разбавления. Յուղային բյուրեղյա սերմերի արտադրություն: Ռաման շղթայի առավելագույն դիրքի ատոմային զանգվածի կախվածությունը:
«Սիլիկոնային դաս» - կենդանի եւ ոչ կենդանի բնության ամենակարեւոր քիմիական տարրերից որն է: Ածխածնի եւ սիլիկոնի օքսիդներ: Նյութը թափանցիկ է: Ոչ մետաղական եւ մետաղական հատկությունների դրսեւորման մասին: Ամփոփելով արտացոլումը: Վերջնական փորձարկում: Ածխածնի եւ սիլիկոնային հիդրօքսիդի օքսիդներ: Ա) հեղուկ, բ) գազ, գ) ամուր:
«Սիլիկոն» `սիլիկոն, պարզ նյութ է: Ֆիզիկական հատկություններ: Սիլիկոնային օքսիդ (IV): Սիլիցիդներ Կենդանի օրգանիզմների իմաստը: Մետաղների հետ փոխազդեցություն: Ոչ-մետաղների հետ փոխազդեցություն: Սիլիկոնային կարբիդ: Սիլիկոն բնության մեջ: Սիլիկոն: Սիլիկատային արդյունաբերության արտադրանք: Բնական սիլիկոնային միացությունների տեսակներից մեկը սիլիկատներն են:
«Կարբոն եւ սիլիկոն» - Սիլիկոնային օքսիդ (IV): Հիմնական ենթախմբի IV խմբի խմբի տարրերը: Թունավորությունը: 7. Հետաքրքիր ածխածնի մասին: Սիլիկատներ: Սահեցրեք դեպի շփումը: Diamond- ը ամենադժվար բնական նյութն է: Քիմիական հատկություններ Մթնոլորտում ածխածնի ավելի քան 99% -ը ածխաթթու գազի տեսքով է: Կարբիդներ: 6. Դիմում: Կամուրջներից ամենափոքրերից մեկը:
Ընդամենը ընդամենը 6 ներկայացում:
