Sio2 ֆիզիկական հատկությունները: Թթվածին միացություններ: Սիլիկոն (II) SiO
Սիլիկոնային օքսիդ (II) SiO. Բնության մեջ դա տեղի չի ունենում, բայց կարելի է արձագանքել.
SiO 2 + Si → 2 SiO- ը:
Նորմալ ճնշման տակ, սիլիկոնային երկօքսիդի ենթլիմացիան սկսվում է մոտավորապես 1200 ° C- ում (երբ սկզբնական նյութերը գրեթե չեն ներթափանցում): Զույգերով, SiO- ն անհատական բաղադրություն է: Էլեմենտների տարրական էներգիան 789 կՋ / մոլ է: Փոխակերպումը ամուր վիճակին կարելի է հասնել միայն գազի փուլի արագ սառեցման («վառելիքի») միջոցով: Հակառակ դեպքում, հավասարման միջոցով դիմանալու ժամանակն անցնում է.
2 SiO = SiO 2 + Si:
Սիլիկոնային երկօքսիդը դանդաղորեն օքսիդացված է մթնոլորտային թթվածնով եւ հեշտությամբ լուծվում է ալկալների մեջ `սիլիցիաթթուների աղեր կազմելու եւ ջրածնի ազատման համար: Այն հեշտությամբ էլեկտրաֆիկացվել է շփման միջոցով, ստանալով ուժեղ բացասական մեղադրանք:
Սիլիկոնային օքսիդ (IV) SiO 2:Silicon oxide (IV) կոչվում է նաեւ silica. Դա կոշտ հրատապ նյութ է: (հալեցման կետ 1700 ° C)տարածված բնույթով `երկու ձեւով. 1) բյուրեղային սիլիկատ - քվարցի հանքանյութի եւ դրա տեսակների (ռոք բյուրեղյա, քալկեդոն, ագատ, ջասեր, շերտ) ձեւով; քվարցը ձեւավորում է շինարարության եւ սիլիկատային արդյունաբերության մեջ լայնորեն կիրառվող քվարցային ավազի հիմքը, 2) ամորֆային սիլիցիում - հանքային օպալ կազմի SiO 2 կազմի ձեւով nH 2 O; ամորֆային սիլիկայի հողային ձեւերը դիատոմիտ են, եռափուլին (infusorial earth); Արհեստական ամորֆ անջուր սիլիկայի օրինակ է սիլիկատային գել, որը ստացվում է նատրիումի մետազիլիկատից.
Silica գել ունի զարգացած մակերեւույթ, եւ, հետեւաբար, լավ ներծծում խոնավության.
1710 ° -ում քվարցը հալեցնում է: Հալած զանգվածի արագ սառեցմամբ ձեւավորվում է քվարցային ապակի: Այն ունի շատ ցածր ընդլայնման գործակից, որպեսզի տաք կվարցային ապակիները չեն փչում, երբ ջուրը արագ սառեցվում է: Լաբորատոր ապակյա արտադրանք եւ գործիքներ գիտական հետազոտությունների համար պատրաստվում են քվարցային ապակուց:
SiO 2- ի կառուցվածքը պատված պատկերով կարող է ներկայացվել հետեւյալ կերպ.
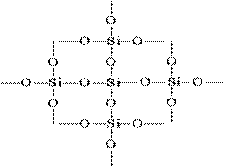
Յուրաքանչյուր սիլիկոնային ատոմ կցվում է 4 թթվածնային ատոմում: Այս դեպքում սիլիկոնային ատոմը գտնվում է կենտրոնում, եւ թթվածնային ատոմները տեղակայված են թեքրադրոնի գագաթներով: Սիլիկայի ամբողջ կտորը կարելի է համարել որպես բյուրեղյա, որի բանաձեւը (SiO 2) n է: Սիլիկոնային օքսիդի նման կառուցվածքը (IV) որոշում է բարձր կոշտության եւ refractoriness- ը:
Սիլիկոնային օքսիդի (IV) SiO 2- ի քիմիական հատկությունները վերաբերում են թթվային օքսիդներին: Երբ խառնվում են պինդ alkalis, հիմնական օքսիդները եւ կարբոնատները, ձեւավորվում են սիլիկոնաթթուների աղեր.
Միայն հիդրոֆուրային թթուները փոխազդում են սիլիկոնային օքսիդով (IV) (ապակեղենի) հետ:
SiO 2 + HF → SiF 4 + H 2 O
Սիլիկոն (IV) օքսիդը չի ջրում ջրում եւ քիմիապես չի փոխազդում դրա հետ: Հետեւաբար, սիլիկոնաթթունն անուղղակի կերպով ձեռք է բերվում, օրինակ `հիդրոիզի միջոցով.
SiS 2 + H 2 O ↔ H 2 S + H 4 SiO 4 orthosilicon թթու:
H 4 SiO 4- ը լուծելի է, երբ ջեռուցվում կամ կանգնած է, սկսվում է պոլիմերացման գործընթաց:
2 H 4 SiO 4 → H 2 O + H 6 Si 2 O 7 diorthocremnievy թթու:
2 H 6 Si 2 O 7 → H 2 O + H 10 Si 4 O 13 tetraorotremilicic թթու:
Նա փակեց ռինգը.
H 10 Si 4 O 13 → H 2 O + (H 2 SiO 3) 4 tetramethacilicic թթու:
Այս դեպքում silicic թթու (կախված նախնական կենտրոնացումը աղ եւ թթու լուծումների) կարող է ձեռք բերել ձեւով դոնդողանման զանգվածային պարունակում է ջրի, եւ այն ձեւով, որը colloidal լուծույթով (sol): Ստացված սիլիցիաթթուի կազմը կախված է նախնական նյութերից եւ պատրաստման պայմաններից: Բոլոր սիլիկիկ թթուները շատ թույլ են (ավելի յուղից):
Եթե ածխաթթուների լուծույթում լուծում է սիլիցիաթթու իր աղերից, ապա հակադարձ ռեակցիան տեղի է ունենում կալցիման ժամանակ: Առաջինը պայմանավորված է սիլիկիկ թթուների ցածր ուժի (դիսեկցիայի աստիճանի), երկրորդը `ջերմացնող ցածր փոփոխականության շնորհիվ:
Երբ ջերմային պոլիսիլիկ թթուները եւ դրանց աստիճանական ջրազրկումը կարող են ձեռք բերել հեղուկ SiO 2, որը կոչվում է սիլիկոնե գել . Այն լավ ներծծում է ջրերը, ես այն տեղադրում եմ սարքերում `կանխելու թանկարժեք տարրերի օքսիդացումը:
Գերմանիայի ենթախումբը
Գ (+4) Sn (+2, +4) Pb(+2) - դիմացկուն օքսիդացման վիճակներ
Գերմանիան 1871 թ. Կանխատեսում էր Դ.Ի. Մենդելեեւի կողմից եւ հայտնաբերվել է 1886 թ .: Ակոսը եւ կապարը պատկանում են տարրերին, որոնք շատ հայտնի են մարդկության համար: Եգիպտացիները ի վիճակի էին հոտել նրանց մ.թ.ա. ավելի քան 3000 տարի: er Հնդկաստանում կապարի հայտնաբերվել է մոտ 2500 տարի, իսկ մ.թ.ա. 1500 թ. er Հին Չինաստանում արտադրվող մածուցիկ թիթեղ:
Ստացական:Գերմնամի բնական միացությունները վերափոխվում են GeO 2 եւ կրճատվում են ջրածինով.
GeO 2 + H 2 t → Ge + H 2 O մոտ 1000 ° C ջերմաստիճանում:
Թիթեղը ստացվում է բնական հանքից Կասիտերիտ(SnO 2):
SnO 2 + C → Sn + CO.
Արդյունաբերական կապարի նվազեցման ամենապարզ սխեմը հիմնված է երկու հաջորդական արձագանքների վրա.
PbS + O 2 → SO 2 + PbO Գալենա(PbS) այրվում է, հետո կրճատվում է ածուխով.
PbO + С → Սո + Պբ.
Դիմում:Բոլոր երեք տարրերը շատ կարեւոր են ժամանակակից տեխնոլոգիաների համար: Ողջույնի եւ կապարի որոշ միացություններ նույնպես մեծ նշանակություն ունեն: Առաջատար ածանցյալները շատ թունավոր են:
Գերմանիան բնորոշ կիսահաղորդիչ է (n-type- ը, 0.75 պրոտոնների լայնությամբ) եւ գտնում է տարբեր կիրառանքներ էլեկտրական տեխնիկայի մեջ: Այն առավել լայնորեն կիրառվում է AC ուղղիչ սարքերի արտադրության համար:. Այս կիրառությունը հիմնված է մաքուր գերմանական եւ գերմանական խառնուրդի հետ ներդիրի շփման արդյունքում առաջացող անկյունաչափ հաղորդակցությանը: Ընթացիկ (էլեկտրոնային հոսքը) նման տեղադրությունում անցնում է գրեթե միայն գերմանականից մինչեւ խառնուրդ, բայց ոչ թե հակառակը: Գերմանական ուղղիչ սարքավորումները բնութագրվում են չափազանց բարձր (մոտ 98%) արդյունավետության եւ շատ մեծ (պատշաճ շահագործման) ծառայության ժամանակ: Նման ուղղիչ սարքերի հիմնական թերությունը նրանց ջերմության զգայունությունն է `70 ° C- ից բարձր, դրանց արդյունավետությունը արագորեն կաթվածահար է:
Կարեւոր օգտագործման տարածք Գերմանիան ինֆրակարմիր օպտիկա է, քանի որ 2 րոպեից ավելի ալիքի երկարությամբ ճառագայթները գործնականում հետաձգում են: Ընդհակառակը, լույսի ներքո եւ մոտակայքում (0,2,2 մմ), գերմանն ինտենսիվ ներծծում է էներգիան: Եթե փայլուն մետաղական մակերեւույթը (որը ջերմության լավ է պահում, բայց չի ջերմացնում), ծածկված է գերմանական ֆիլմով, ապա մակերեսը շատ ավելի շատ է տաքանում, քան առանց ֆիլմի: Տեղեկացվեց, որ արեւի լույսի ներքո այս ձեւով պատրաստված բարելից կարելի է ձեռք բերել եռացող ջուր:
Թիթեղը հիմնականում օգտագործվում է երկաթի մաքրման համար `այն ժանգոտելու համար: (պահեստավորման համար թիթեղ): Նման թիթեղների ծածկույթը շատ փոքր է `մանրադիտակների կարգի վրա: Հատուկ թերթիկների (այսպես կոչված, Stannioles) ձեւով թիթեղը սպառվում է էլեկտրական արդյունաբերության կոնդենսատորների արտադրության համար . Առաջատարը օգտագործվում է մարտկոցների, էլեկտրական մալուխների, փամփուշտների եւ կրակոցների արտադրության համար, պաշտպանելու ռենտգենյան ճառագայթներից եւ ճառագայթներից, ինչպես նաեւ քիմիական արդյունաբերության (խողովակաշարերի եւ այլն) պաշտպանությունից: Շատ մեծ քանակությամբ թիթեղից եւ կապարից ծախսվում են մի շարք տեխնիկապես կարեւոր նյութերի արտադրության վրա:
Առավել կարեւոր սրանք տարբեր բրոնզե (Cu եւ համաձուլվածքների Sn) համար կրելով համաձուլվածքների (BABBITT մետաղական, հիմնված սովորաբար արտադրվում Pb կամ Sn պարունակող նաեւ SB եւ Cu), համաձուլվածքներ, տպագրություն (5-30% Կիր 10-20% Sb, մնացածը `Pb) եւ սովորական« փափուկ »մածուցիկը (30-70% Sn, 70-30% Pb): Այն կարող է փոխարինվել ավելի ցածր խառնուրդով 90% Pb, 6% Sn, 4% Sb: Կարեւոր նշանակություն ունի, որ 98% Pb, 1% Ca, 1% Na- ի մոտավոր բաղադրություն ունեցող առանցքակալներ են:
Silica (silica, silica) մի նյութ է, որը բաղկացած է անգույն բյուրեղներից, բարձր ուժով, կարծրություն եւ refractoriness: Սիլիկոնային երկօքսիդը կայուն է թթուների համար եւ չի փոխազդում ջրի հետ: Ռեակցիայի ջերմաստիճանի բարձրացման հետ մեկտեղ նյութը փոխազդեցություն է խառնուրդի հետ, ածխաջրածին թթուով լուծվող, հիանալի դիէլեկտրիկ:
Բնության մեջ, silica բաշխվում բավականին լայնորեն: բյուրեղային սիլիցիում օքսիդ ներկայացված օգտակար հանածոների, ինչպիսիք են Jasper, ագատ (տուգանք բյուրեղային silica բաղադրություն), ռոք բյուրեղյա (խոշոր բյուրեղներով նյութի), որձաքար (ազատ silica), քաղկեդոն, մեղեսիկ, Morion, Topaz (գունավոր բյուրեղների silica):
Նորմալ պայմաններում (բնական միջավայրի ջերմաստիճանում եւ ճնշման դեպքում) գոյություն ունեն սիլիցիումի երկօքսիդի երեք բյուրեղային փոփոխություններ `տրիդիմիտ, քվարց եւ քրիստոբիտիտ: Երբ ջերմաստիճանը բարձրանում է, սիլիկոնային երկօքսիդը առաջին հերթին վերածվում է կոեսիտի, ապա `ստիշովիտի (1962 թ. Հայտնաբերված հանքանյութ, մետեորիտե խառնարանով): Ուսումնասիրությունների համաձայն, դա ստիշովիտ է, սիլիցիումի երկօքսիդի ածանցյալը, որը գծերը Երկրի մոնտաժի մեծ մասը:
Նյութի քիմիական բանաձեւը `SiO 2
Սիլիկայի պատրաստում
Սիլիցիումի երկօքսիդ ձեռք բերել արդյունաբերական մեթոդներով համար որձաքար գործարաններում արտադրող մաքուր որձաքար խտանյութ, որն այնուհետեւ օգտագործվում է քիմիական եւ էլեկտրոնային արդյունաբերության, արտադրության օպտիկայի, fillers համար ներկերի եւ ռետինե արտադրանք, արտադրության զարդեր եւ այլն Բնական սիլիցիումի երկօքսիդը, որը կոչվում է «օ silica», լայնորեն կիրառվում է շինարարության մեջ (բետոնե, ավազ, ձայնային եւ ջերմային մեկուսիչ նյութեր):
Պատրաստում սիլիցիումային երկօքսիդի կատարված synthetically օգտագործելով թթուներ ազդեցություն նատրիումի սիլիկատային, որոշ դեպքերում `այլ լուծվող սիլիկատների կամ մակարդում colloidal silica ազդեցության տակ իոնների. Բացի այդ, սիլիկոնային երկօքսիդը արտադրվում է թթվածինով սիլիցիումի օքսիդացումով մոտ 500 աստիճան ջերմաստիճանի պայմաններում:
Սիլիկոնային երկօքսիդի կիրառումը
Սիլիկոն պարունակող նյութերը լայնորեն օգտագործվում են ինչպես բարձր տեխնոլոգիաների, այնպես էլ առօրյա կյանքում: Սիլիկոնային երկօքսիդը օգտագործվում է ապակու, կերամիկայի, բետոնի արտադրանքի, հղկվող նյութերի, ինչպես նաեւ ռադիոտեխնիկայի, ուլտրաձայնային սարքավորումների, վառելիքի եւ այլն: Մի շարք բաղադրիչների հետ համատեղ օպտիկամանրաթելային մալուխների արտադրության մեջ օգտագործվում է սիլիկան:
Ոչ ծակոտկեն ամորֆային սիլիկոնային երկօքսիդը նաեւ սննդի արդյունաբերության մեջ օգտագործվում է որպես հավելում, որը գրանցված է E551 համարով, կանխարգելելով հիմնական արտադրանքի կլանումը եւ թրթռումը: Դիօքսիդ  սիլիկոնային սննդամթերքը դեղագործական արդյունաբերության մեջ օգտագործվում է որպես թմրադեղերի մագնիտոֆոն, ատամի մածուկների արտադրության մեջ: Բաղադրությունը հայտնաբերվել է չիպսեր, կոտրիչ, եգիպտացորենի ձողիկներ, լուծվող սուրճ եւ այլն:
սիլիկոնային սննդամթերքը դեղագործական արդյունաբերության մեջ օգտագործվում է որպես թմրադեղերի մագնիտոֆոն, ատամի մածուկների արտադրության մեջ: Բաղադրությունը հայտնաբերվել է չիպսեր, կոտրիչ, եգիպտացորենի ձողիկներ, լուծվող սուրճ եւ այլն:
Silica վնաս
Պաշտոնականորեն հաստատում է, որ սիլիկոնային երկօքսիդի նյութը անցնում է ստամոքս-աղիքային տրակտի միջոցով անփոփոխ, այնուհետեւ այն ամբողջությամբ հանվում է մարմնից: Ֆրանսիական փորձագետների 15-ամյա հետազոտության համաձայն, խմելով բարձր ալյումինային խմելու ջուրը նվազեցնում է Ալցհեյմերի հիվանդության զարգացման ռիսկը 10% -ով:
Այսպիսով, սիլիկոնային երկօքսիդի, որը քիմիապես իներտ նյութի վտանգավորության մասին տեղեկությունները, կեղծ են. Առողջության համար ամբողջովին անվտանգ է E551 դիետիկ հավելումը, որը ներծծվում է բանավոր կերպով:
Silicon օքսիդ SiO 2 - պինդ, շատ հրակայուն նյութ (հալման կետը 1700 ° C), համատարած բնույթ, որտեղ այն հիմնականում հայտնաբերվել է ձեւով հանքային որձաքար եւ cristobalite եւ tridymite:
Կա սովորական ջերմաստիճաններում կայուն փոփոխություն է նկատվում, աճում է ջերմաստիճանի պոլիմորֆիկ վերափոխումները.
Մելոմերի տեսքով բոլոր փոփոխությունների սիլիկոն գոյություն չունի. այն մշտապես պոլիմերային է եւ «կառուցված» է մակերեւույթից, կազմելով շատ ուժեղ ատոմային վանդակ
Յուրաքանչյուր սիլիկոնային ատոմ (SiO 2) n բյուրեղների մեջ tetrahedrally շրջապատված է չորս թթվածին ատոմների, որոնցից յուրաքանչյուրը կամուրջ է: Միասնական թթվածնային ատոմի շնորհիվ, թեքահարթակները տարբեր անկյուններում կապում են միմյանց, կազմելով շարունակական եռաչափ ցանց: տիեզերքի փոխազդեցությունը տիեզերքում որոշում է սիլիկայի մեկ կամ մի քանի փոփոխություն:
Սիլիկատային կապի փոփոխության տարբեր փոփոխություններ տարբեր են: Սա ազդում է Սի-Օ-Սի անկյունների եւ Si-O հեռավորությունների մեծության վրա, օրինակ, Si-O-Si- ի սղոցային անկյունը տարբեր եղանակների փոփոխությունների ժամանակ 120-ից 180 ° է: Քվարց-տրիդիմիտ-քրիստոբիտային անցումները ուղեկցվում են պարտքերի խախտմամբ եւ վերափոխմամբ, որոնք կարող են առաջանալ միայն բարձր ջերմաստիճաններում:
Քվարց Հաճախ բնության մեջ հայտնաբերվել է չափազանց լավ ձեւավորված բյուրեղների տեսքով, երբեմն զգալի չափով: Բյուրեղները ձեւավորվում են tetrahedra- ից, որը կազմված է կենտրոնական առանցքի պարուրաձեւ ձեւով, պարուրաձեւ ձեւով: Նույն բյուրեղներում ուղղահայաց ուղղությունը կարող է հակառակ լինել: Նման բյուրեղները օպտիկական են: Նրանք պտտում են լույսի բեւեռացումի ինքնաթիռը եւ կարող են լինել ճիշտ եւ ձախ: Այդ եւ այլ բյուրեղները տարբերվում են իրենց հայելային պատկերից:
Քվարցը օգտագործվում է գիտության եւ տեխնոլոգիայի տարբեր ոլորտներում, եւ դրա բյուրեղները հաճախ աճում են արհեստականորեն: Որոշ քվարցի տեսակներ հատուկ անուններ են: Թափանցիկ անգույն բյուրեղները կոչվում են ռոք բյուրեղ: Գոյություն ունեն նաեւ քվարցի գունավոր սորտեր `վարդագույն քվարց, մանուշակ (ամեթիստ), մուգ շագանակագույն (ծխագույն տոպազ), կանաչ (քրիզոպրազ) եւ այլն: Այլ նյութերի հավելումներով քվարցի բյուրեղային փոփոխությունը կոչվում է քաղկեդոնիա: Կալցեդոնիի սորտերը կանաչապատ, ժասպեր եւ այլն են: Քարերի ռոք բյուրեղները եւ գունավոր սորտերը օգտագործվում են որպես թանկարժեք եւ կիսաթանկարժեք քարեր:
Տրիդիմիտը տեղի է ունենում հրաբխային ժայռերի մեջ, բայց շատ փոքր քանակությամբ: Հայտնի տրիդիմիտ եւ մետեորիտ ծագում:
Բնության մեջ գտնվող քրիստոբիտիտը երբեմն հայտնաբերվում է լոբայի մեջ ներկված փոքր բյուրեղների տեսքով, ինչպես հարթակի մեջ: Թրիտիմիտը եւ քրիստոբիտիտը ավելի «կորցնող» կառույց են, քան քվարցը: Այսպիսով, կիստոբոբիտի, տրիդիմիտի եւ քվարցի խտությունը 2.32 է. Համապատասխանաբար 2.26 եւ 2.65 գ / սմ 3:
Սիլիկան հալեցնում է դանդաղ սառեցման միջոցով, հեշտությամբ ձեւացնում է ամորֆային քվարցային ապակիներ: Սիլիկոն ապակու տեսքով նույնպես հայտնաբերված է բնության մեջ: Ամորֆային ապակիների խտությունը 2.20 գ / սմ է `ցածր, քան բյուրեղային բոլոր փոփոխությունները: Քվարցային ապակիները ունեն ընդարձակման փոքր ջերմաստիճանի գործակից, հետեւաբար, այն օգտագործվում է լաբորատոր ապակուց պատրաստելու համար, որը դիմակայվում է ջերմաստիճանի անսպասելի փոփոխություններին:
Ջրի մեջ սիլիկայի բոլոր փոփոխությունները գործնականում անլուծելի են (25 ° C ջերմաստիճանի դեպքում, կվարցի լուծույթը `7, կրիստոբիթիտը` 12, տրիդիմիտ `16, քվարցային ապակի` 83 մգ / լ): Հետեւաբար նորմալ պայմաններում գործում են միայն ալկալային լուծումներ եւ հիդրոֆլորութրիտներ:
SiO 2 + 2KO = K 2 SiO 3 + H 2 O, (1)
SiO 2 + 4HF = SiF 4 + 2H 2 O. (2)
Վերջին ռեակցիան օգտագործվում է ապակու «փաթաթվածում»:
Ավելացված սիլիկոնն արձագանքում է հիմնական օքսիդների, alkalis- ի (արձագանք (1)) եւ կարբոնատների `սիլիկատների ձեւավորման համար.
SiO 2 + CaO = СaSiO 3, (3)
SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2: (4)
Ռեակցիաները (3) եւ (4) հիմնվում են տարբեր ակնոցների, ինչպես նաեւ ցեմենտի արդյունաբերական արտադրության վրա: Այսպիսով, սովորական ապակիների կազմը (օրինակ, պատուհանը, ճաշատեսակների արտադրության համար) արտահայտվում է Na 2 O. CaO բանաձեւով: 6SiO 2. Նման ապակիները արտադրվում են սոդայի, ավազի եւ կրաքարի խառնուրդով: Գործընթացը իրականացվում է ~ 1400 ° C ջերմաստիճանում մինչեւ գազերի ամբողջական հեռացում.
Na 2 CO 3 + CaCO 3 + 6SiO 2 = Na 2 O. CaO. 6SiO 2 + 2CO 2.
Ապակու հատուկ դասարանների համար `հրակայուն,« անխախտ », երբ պատրաստում են բարիում, կապարի, բորի օքսիդներ: Գունավոր ակնոցներ ձեռք բերելու համար կիրառվում են նաեւ տարբեր հավելումներ, օրինակ, կոբալտի օքսիդ Co 2 O 3- ի ավելացումը թույլ է տալիս կապույտ գույնը, քրոմի օքսիդ Cr 2 O 3 կանաչ մանանիական երկօքսիդ MnO 2 - վարդագույն:
SiO 2 օքսիդը հանդիսանում է մի շարք սիլիկիկ թթուների anhydride, որի կազմը կարող է արտահայտվել xSiO 2 ∙ yH 2 O ընդհանուր բանաձեւով, որտեղ x- ը եւ y- ը հանդիսանում են ամբողջական թվեր. 1) x = 1, y = 1: SiO 2: Հ 2 Օհ, մանավանդ, H 2 SiO 3 - մետա-սիլիկոնաթթու; 1) x = 1, y = 2 `SiO 2: 2H 2 O, այսինքն, orthosilicic թթու; 1) x = 2, y = 1: 2SiO 2: Հ 2 Օհ, մանավանդ, H 2 Si 2 O 5 - բիմետա սիլիկոնաթթու:
Թթվածներ, որոնց մոլեկուլները պարունակում են ավելի քան մեկ SiO 2 մոլեկուլ, պատկանում են polysilicon:
Առավել պարզ սիլիկիկ թթուների քանակը H 2 SiO 3 է, որը հաճախ կոչվում է պարզապես սիլիկոն, եւ նրա աղերը սիլիկատ են: Սիլիկատներից միայն նատրիումի եւ կալիումի սիլիկատները լուծելի են ջրի մեջ, մնացած սիլիկատները `հուսալով, ջրի լուծելի նյութերով:
Սիլիկատների լուծույթները աճում են աղտոտվածության մեջ, քանի որ CO 2- ը պարունակում է իր սաղարթաթթուներից (H 2 SiO 3- ն ավելի թույլ է, քան ածխաթթու գազը, իսկ առաջին փուլում H 2 SiO 3- ի դիսոցացիոն հաստատունը հավասար է K1 = 2.2: 10 -10 ):
H 2 SiO 3 գրեթե անլուծելի է ջրի մեջ, այս հատկությունը օգտագործվում է որպես որակական ռեակցիա սիլիկատային իոնների հայտնաբերման համար.
Na 2 SiO 3 + CO 2 + H 2 O = Na 2 CO 3 + H 2 SiO 3 ↓.
Սիլիկատները ձեռք են բերվում SiO 2- ի հետ, alkalis- ով կամ կարբոնաթներով:
Նատրիումի եւ կալիումի սիլիկատների կոնցենտրացված լուծույթները կոչվում են հեղուկ ապակի, նրանք ունեն ուժեղ ալկալային ռեակցիա `պայմանավորված այն հանգամանքով, որ դրանք բարձր հիդրոդլիզացված են.
K 2 SiO 3 + H 2 O 2KON + H 2 SiO 3 ↓.
Հեղուկ ապակի օգտագործվում է, օրինակ, սոսինձի, անջրանցիկ գործվածքների արտադրության համար:
Ցեմենտը շատ լայնորեն օգտագործվում է շինարարության մեջ, որպես կապակցում, որը խառնվում է ջրի հետ: Սովորաբար, ցեմենտը արտադրվում է խոշոր պտուտահաստոցներում, որտեղ տարբեր սիլիկատներ են աղացած եւ հիմք (-1000 ° C ջերմաստիճանի դեպքում):
Ցեմենտի մի քանի տեսակներ կան, սակայն պայմանականորեն հնարավոր է տարբերակել ցեմենտի երկու տեսակ `ըստ իրենց« կոագուլյացիայի »սկզբունքի` սովորական ցեմենտի եւ պորտլանդական ցեմենտի: Կալցիումի սիլիկատից բաղկացած սովորական ցեմենտի «կարգավորման» գործընթացը տեղի է ունենում օդում ածխածնի երկօքսիդի պատճառով կալցիումի կարբոնատի ձեւավորման շնորհիվ.
Cao. SiO 2 + CO 2 + H 2 O = CaCO 3 ↓ + H 2 SiO 3 ↓.
Պորտլենդ ցեմենտի ածխաթթու երկօքսիդը կարգավորելու ժամանակ գործընթացը ներգրավված չէ, եւ սիլիկատների հիդրոիզացումը տեղի է ունենում լուծելի բյուրեղային հիդրիների ձեւավորման հետ `
Ca 3 SiO 5 + H 2 O = Ca 2 SiO 4 + Ca (OH) 2,
Ca 2 SiO 4 + 4H 2 O = Ca 2 SiO 4. 4H 2 O ↓.
· Կարբիդներ եւ սիլիցիդներ
Ածխածնային եւ սիլիկոնային միացություններ մետաղների հետ `խառնուրդներ եւ սիլիցիդներ, ինչպես նաեւ դիտարկվող ռեակցիաների հետ մեկտեղ, ձեռք են բերվում նաեւ սիլիցիումի մետաղի հիդրոդերի փոխազդեցության շնորհիվ, օրինակ.
· 2CaH 2 + Si = Ca 2 Si + 2H 2:
· Բոլոր ռեակցիաները տեղի են ունենում բարձր ջերմաստիճաններում: Կարբիդների շարքում են այսպես կոչված «մետանիդները» եւ «ացետիլենը»: Առաջինները համարվում են որպես ածխածնի պարունակող ածանցյալ ածանցյալներ `օքսիդացման վիճակում -4 (Be 2 C, Al 4 C 3), երկրորդը, որպես ածխածնի օքսիդացման աստիճան ունեցող ացետիլենային ածանցյալներ (Li 2 C 2, Ag 2 C 2, Cu 2 C 2 , CAC 2): Արծաթի եւ պղնձի (I) ացետիլիդները հեշտությամբ կարելի է ձեռք բերել ոսկրային օքսիդի կամ պղնձի (I) քլորիդի ամոնիակ լուծույթով անցնելու միջոցով: Մեթանիդների եւ ացետիլիդների մեծամասնությունը ակտիվորեն արձագանքում են ջրով (հատկապես թթուներով), ազատելով համապատասխան ածխաջրածինները.
· СС 2 + 2Н 2 О = Са (ОН) 2 + С 2 Н 2,
· Al 4 C 3 + 12H 2 O = 4Al (OH) 3 ↓ + 3CH 4,
· Ag 2 C 2 + 2HCl = 2AgCl ↓ + C 2 H 2:
· Ի տարբերություն կարբիդների, միայն ալկալային կամ ալկալային հողային մետաղների սիլիցիդները փոխազդում են ջրի եւ թթուների հետ `արտադրելով պարզագույն ջրածնի բաղադրություն սիլիցիումի մոնսիլենան, որը հաճախ կոչվում է պարզապես սիլան SiN 4:
· Ca 2 Si + 4HCl = 2CaCl 2 + SiH 4:
· Silane- ը անգույն գազ է, որը ունի բորբոս հոտ, ինքնաբերաբար այրվող օդում, այրվում է SiO 2 եւ ջուր:
· SiH 4 + 2O 2 = SiO 2 + 2H 2 O.
· Ալկալիները հեշտությամբ լուծում են սիլան `հավասարմամբ.
· SiH 4 + 2KON + H 2 O = K 2 SiO 3 + 4H 2,
· Ջուրը նույնպես hydlyzes silane, բայց շատ դանդաղ:
· SiH 4 + 2H 2 O = SiO 2 + 4H 2:
· 400 ° C-ից բարձր ջերմաստիճան առանց օդային մուտքի, silane decomposes into silicon եւ hydrogen (սիլիկոն արտադրության մեթոդներից մեկը):
· SiH 4 = Si + 2H 2:
· Բացի այդ, հայտնի են նաեւ մոնոսիլեն, դիալիլան Si 2 H 6, trisilane Si 3 H 8, tetrasilane Si 4 H 10 եւ այլն: Անհատական վիճակում միացությունները մեկուսացված էին միայն մինչեւ Si 6 H 14 ներառյալ: Բոլոր այս միացությունները պատկանում են սիլանների համրերի շարքին, որոնցում համապատասխանում է Si n H 2 n + 2 ընդհանուր բանաձեւը: Ալկանների նման, սիլաներն անգույն են, homologous շարքի առաջին անդամները նորմալ պայմաններում գազային են, որոնցից են հեղուկները: Silanes- ի եւ ածխաջրածինների քիմիական ակտիվությունը տարբերվում է, ի տարբերություն բավականին աներկր ալկանների, սիլանային բոլոր ռեակտիվները: Սա պայմանավորված է ցածր սիլիկոնային հարստության համար ջրածնի համեմատ ածխածնի եւ շատ բարձր հարստության սիլիկոն թթվածնի համար: Ավելին, Si-Si պարտատոմսերը պակաս ամուր են, քան Ս-Ս պարտատոմսերը: Ի տարբերություն C - H պարտատոմսերի, Si - H պարտատոմսը ունի ավելի շատ իոնային բնույթ:
· Si-E եւ CE պարտատոմսերի էներգիան:
Si-Si պարկի ցածր ուժը պայմանավորված է սիլանների հոմոլոգիական շարքի սահմանափակությամբ:
· Կարիբիդների եւ սիլիցիդների շարքում հատուկ տեղ զբաղեցնում է կարբորունդ SiC- ը, որը կարելի է անվանել ինչպես սիլիկոնային կարբիդ, այնպես էլ ածխաջրածին: Carborundum ունի բարձր հալեցման կետ `ադամանդի նման կառույցի շնորհիվ, նրա կարծրությունը մոտ է ադամանդի: Քիմիապես SiC- ը շատ կայուն է:
· Colloidal լուծումների հայեցակարգը
Բնության եւ տեխնոլոգիայի մեջ ցրված համակարգերը հաճախ հայտնաբերվում են, երբ մեկ նյութը հավասարապես տարածվում է որպես այլ նյութի ներսում մասնիկներ:
Ցնցված համակարգերում գոյություն ունի ցրված փուլ, որը զուսպ բաժանված նյութ է եւ ցրված միջավայր `միատարր նյութ, որում ցրված փուլը տարածվում է: Ցողունային համակարգերը ներառում են սովորական (ճշմարիտ) լուծումներ, կոլոիդ լուծումներ, ինչպես նաեւ կախոցներ եւ էմուլսիա: Նրանք տարբերվում են միմյանցից հիմնականում մասնիկների չափերով, այսինքն `ցրման աստիճանը (փխրման):
1 նմ-ից պակաս մասնիկի համակարգեր ճշմարիտ լուծումներ են, որոնք լուծելի մոլեկուլներից կամ իոններից են: Նրանք պետք է համարվեն որպես մեկ փուլային համակարգ: 100 նմ-ից բարձր մասնիկների չափման համակարգեր կոշտ սկավառակային համակարգեր են `կասեցումներ եւ էմուլսիա:
Կախոցներ ցրված համակարգեր են, որոնցում ցրված փուլը ամուր է, եւ ցրված միջավայրը հեղուկ է, իսկ ամուրը գործնականում լուծելի է հեղուկում:
Էմուլսիաները ցրված են համակարգեր, որտեղ երկուսն էլ ցրված փուլն ու ցրված միջավայրը հեղուկներ են, որոնք փոխադարձաբար չեն խառնվում: Էմուլսիայի օրինակը կաթն է, որի մեջ փոքր ճարպը լողում է հեղուկում:
Կասեցումները եւ էմուլսիաները երկֆազային համակարգեր են:
Colloidal լուծույթները խիստ ցրված են երկպառիչ համակարգեր, որոնք կազմված են ցրված միջավայրից եւ ցրված փուլից, եւ վերջինների մասնիկների գծային չափսերը գտնվում են 1-ից 100 նմ-ի սահմաններում: Ինչպես տեսնում ենք, մասնիկի չափսերով կոլոիդ լուծույթները միջանկյալ են ճշմարիտ լուծումների եւ կասեցումների եւ էմուլսիաների միջեւ: Colloidal մասնիկները սովորաբար բաղկացած են մեծ քանակությամբ մոլեկուլների կամ իոններից:
Colloidal լուծումները կոչվում են նաեւ sols: Դրանք ստանում են ցրման եւ խտացման մեթոդներով: Շերտավորումը հաճախ կատարվում է օգտագործելով հատուկ «կոլոիդային կուլտուրաներ»: Կոնդենսացիոն մեթոդում կոլոիդային մասնիկները ձեւավորվում են ատոմների կամ մոլեկուլների միավորումով ագրեգատների մեջ: Շատ քիմիական ռեակցիաների ընթացքում խտացում է տեղի ունենում եւ կազմվում են բարձր ցրված համակարգեր (տեղումներ, հիդրոդիսներ, օքսիդացում-կրճատման ռեակցիաներ եւ այլն):
1 նմ - նանոմետր (1 նմ = 10 -9 մ):
Ի տարբերություն ճշմարիտ լուծումների, սինդսերը բնութագրվում են Tyndall ազդեցությամբ, այսինքն, լոտի ցրումը կոլոիդային մասնիկների կողմից: Երբ լույսի լույսը հայտնվում է լույսի փնջով, այն հայտնվում է խավար սենյակում: 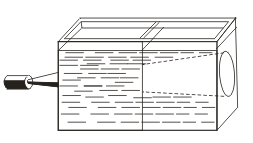 . Այսպիսով, դուք կարող եք ճանաչել, թե արդյոք այս լուծումը colloidal կամ ճշմարիտ է:
. Այսպիսով, դուք կարող եք ճանաչել, թե արդյոք այս լուծումը colloidal կամ ճշմարիտ է:
Sols- ի կարեւոր հատկություններից մեկն այն է, որ դրանց մասնիկները նույն նշանի էլեկտրական հոսանք ունեն: Դրա շնորհիվ նրանք չեն միանում ավելի մեծ մասնիկների եւ չեն թաղում: Միեւնույն ժամանակ որոշ մակերեսների մասնիկներ, օրինակ, մետաղներ, սուլֆիդներ, սիլիցիում եւ անագ թթուներ, ունեն բացասական լիցք, իսկ մյուսները, օրինակ, հիդրոքսիդները, մետաղական օքսիդները, ունեն դրական լիցք: Գումարի հայտնաբերումը բացատրվում է լուծումներից գաղութի մասնիկների կողմից իոնների adsorption- ի կողմից:
Ձուլելու համար անհրաժեշտ է իր մասնիկների միաձուլումը ավելի մեծ ագրեգատների մեջ: Մասնիկների մեծ մասի մեջ համադրությունը կոչվում է կոագուլատիա, եւ դրանց ծանրության ազդեցության տակ նստվածքները կոչվում են նստվածք:
Սովորաբար կոագուլյացիա է տեղի ունենում, երբ ավելացնում է sols: 1) էլեկտրոլիտ, 2) մեկ այլ մկնիկ, որի մասնիկները հակառակ մեղադրանք ունեն, եւ 3) երբ ջեռուցվում է:
