Spoluki sirki. Koraci oksidirane vode u pozadini. Formule sa polu-sirki. Syrka. Sirvoden. sulfid
Sirka, njen fizički i hemijski autoritet. Biološko značenje syrki, í̈zasosuvannya (demerkurizacija).
Sumpor u prirodi
native sirka
PbS - olovni blisk
Cu 2 S- midniy blisk
ZnS - cink blende
FeS 2 - pirit, pirit, kotya zlato
H 2 S- sir voda (u mineralnim džerelima i prirodnom gasu)
CaSO 4 * 2H2 O- kukovi
MgSO 4 * 7H2 O- girka sil (engleski)
Na 2 SO 4 * 10 H 2 O- glauberov sil (mirabilit)
Fizička snaga
Čvrsti kristalni govor iste boje, neraskidiv u blizini vode, voda se ne kvasi (pluta na površini), t° bala = 445°C.
Jedna od posebnih fizičkih moći sirke -flotacijaDobrota vode za spajanje praha, koja je sjajan kristal za potonuće u blizini vode. Na desnoj strani, gdje voda ne ponire, a čestice su podrezane na površini vode, a druge lukovice zalijepljene za njih rakhunokom.Moć zlobe kada se vidi domaće sjeme iz kuća. Ruda je plitka, zalivena vodom, a odozdo je raznose vjetrovi, pljusak vode, a kuće se na dnu pune vodom.alotropija
Za serki je karakterističan prskanje alotropnih modifikacija, ale nibilsh vídomí vidosmíni:rombični (kristalno) , monoclinna(holchasta) і plastika .
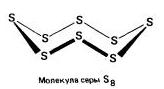
romb (a - sirka) - S 8
t ° pl. = 113 °C; ρ = 2,07 g/cm 3. Najbolja moguća modifikacija.
monoklina (b - sirka) - S 8
tamno obojene glave, t ° pl. = 119 °C; ρ = 1,96 g/cm3. Odrezak na temperaturama do 96°C; sa duhovitim umovima, pretvoriće se u romb.
Plastika S n
smeđa gumasta (amorfna) masa. Nestiyka, kada se očvrsne, pretvoriće se u dijamant.
UKLANJANJE PLASTIKE
Budova atom sirka
Distribucija elektronike po nivoima i podnivoima
glavni kamp
1s 2 2s 2 2p 6 3s 2 3p 4
Distribucija elektronike po
orbitale (loptica za odmor)korak
oksidiranovalence
U glavnom kampu
Perche zbujeniy stan
Još jedan zbujeniy stan
otrimannya sírki
1. Promisloviy metod - viplavlenya iz rude za dodatnu vodu opkladu.
2. Nepotpuno oksidirana voda (nekiseline).
2H 2 S + O 2 = 2S + 2H 2 O
3. Reakcija Wackenrodera
2H 2 S + SO 2 = 3S + 2H 2 O
Hemija moći svijeta
Sírka - oksidirajuće S 0 + 2ē→ S -2 | sirka - glavni službenik: S - 4ē→ S +4; S - 6ē→ S +6 |
1. Vzaêmodia sírki sikoristiti sa bujnim i lug-zemljanim metalima, middy, mercury, siblombez grijanja: 2 Na + S→ Na 2 S DOSVID S + Hg = HgS Živa je hlapljiva. Â bet otruyní. Tsya reakcija leži u osnovi vizualne i magnetske žive, na primjer, iz slomljenog medicinskog termometra. Místya, jer nije moguće upotrijebiti mrvicu žive, posuti prahom sírki. Syrka i živa ulaze u reakciju kada su zatvoreni. Rezultat je drzak, neinteligentan i ne dosadan govor. Cijeli proces se zove demerkurizacija 2. Vzaêmodiya sírkic sa najmanjim metalima (krim Au, Pt) pri podesivim t°: 2Al + 3S t → Al 2 S 3 Zn + S t
°
→
ZnS DOSVID Cu + S t
→
CuS DOSVID 3. Vzaêmodia sírki zdeyakim nemetali za izjave binarny spoluk: H 2 + S→ H 2 S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Vzaêmodíya sírki sa kisnem: S + O 2 t ° → S +4 O 2 2 S + 3 O 2 t °; pt → 2 S +6 O 3 2. Vzaêmodiya sírkic halogeni (osim joda): S + Cl 2→ S +2 Cl 2 ** Vzaêmodiya sirki zkiseline - oksidanti: S + 2H 2 SO 4 (konc)→ 3S +4 O 2 + 2H 2 O S + 6HNO 3 (konc)→ H 2 S +6 O 4 + 6NO 2 + 2H 2 O ** Nesrazmjerne reakcije: 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
sisanje
Vulkanizacija gume, odbacivanje ebonita, brisanje sirnika, baruta, u borbi sa školarcima Silskoy vlade, u medicinske svrhe (sirčanske masti za otklanjanje dece od bolesti itd.), za odbacivanje kiselina
Početna zavdannyastav 21; desna 1, 3, 4 strana. 99-100.
dodatkoví zkhadaníya
Završite standardne reakcije, str Podesite performanse koristeći metodu elektronske ravnoteže, uključujući oksidator, preteču.
# 2. Zdíysnít revizija iza šeme:
Tse tsikavo ...
- Umjesto sirki u tijelu ljudi od 70 kg - 140 g.
- Dobu ljudima treba 1 g sirka.
- Zeleni bagati grašak, kvasac, plastika, pšenica, meso, riba, voće i sic mango.
- Syrka bi trebalo da uđe u skladište hormona, vitamina, bilksa, koja se nalazi u hrskavičnom tkivu, u kosi, nigty. Kada postoji nedostatak osjeta u tijelu, dolazi do manjka hrskavosti noći i cista, opadanja kose.
Uživajte u svom zdravlju!Chi znaš vi ..
- Spoluki sirki može poslužiti kao droga;
- Sirka je osnova masti za liječenje gljivičnih bolesti shkiri, za borbu protiv krasta. Natrijum tiosulfat Na 2 S 2 O 3 pobjednički da se bori za nju.
- Mnogo soli hlorovodonične kiseline i za otapanje kristalizacione vode: ZnSO 4 × 7H 2 O i CuSO 4 × 5H 2 O. Njihov zasosovuyut jak antiseptik koriste za zaglađivanje roslina i drobljenje žitarica u borbi sa školarcima Silskoy vlade.
- Zalizni vitriol FeSO 4 × 7H 2 O vicoristovy s anemijom.
- BaSO 4 zasosovyat u rendgenografskim dozama slunk í crijeva.
- Alumokalíeví galun KAI (SO 4) 2 × 12H 2 O - krvno-spinalni rast u poroznosti.
- Mineral Na 2 SO 4 × 10H 2 Nazvat ću je "Glauberova moć" u čast glaukohemičara Glaubera I.R. Uopšte ne, ali klošarka je dizajnirana da bude prihvaćena. Jedan od stanovnika grada ga je poslao u džerel. Yak tilki vin vipiv flašu slane vode, odmah se zemlja natopi. Glauber je stigao do vode, a zatim kristalizirao s Na 2 SO 4 × 10H 2 O. Zaraza í̈í̈ zasosovyat jak nosi u medicini, s farbuvanní pamučno-papirnim tkaninama. Možete ga pronaći i na vyrobnitsví skla.
- Drveće može pomjeriti građenje tla sa zemlje i stimulirati prianjanje elementa s suspendiranim rosama.
- Chasnik vidílyaê rechovinu - albucid Tsy govor za bolest, povjerenje za stare, prevladavanje srca zbog bolesti.
Grupa halkogena uključuje sirku – niz drugih elemenata, kao što je veliki broj rodova rude. Sulfati, sulfidi, oksidi i spoluci su još širi, važni u industriji i prirodi. Tome je u podacima statistike jasno, kao smrad koji zvecka, ali to je sama sirka, a govor je jednostavan.
Syrka i íí̈ karakteristike
Danski element se takođe može naći u periodičnom sistemu.
- Šosta grupa, šef grupe.
- Treći period Malija.
- Atomska masa - 32.064.
- Serijski broj je 16, protoni i elektroni stila, neutroni su također 16.
- Dozvoljeno za nemetalne elemente.
- Formule glase, yak "es", naziv elementa je sirka, latinski sumpor.
U prirodi postoje čotiri stabilni izotopi sa masenim brojevima 32.33.34 i 36. Danska je najbolji element za širenje u prirodi. Upoznavanje sa biogenim elementima, kako bi ušli u skladište važnih organskih molekula.
Elektronska budova atoma
Spoluci vrana vezani su svojom vlastitom svestranošću za posebnosti elektronskog budžeta atoma. Vono okreni formulu ofanzivne konfiguracije: 1s 2 2s 2 2p 6 3s 2 3p 4.
Redoslijed se prikazuje kada je stacionarni mlin instaliran. Međutim, čini se da ako se čini da atom ima dodatnu snagu, onda je moguće podijeliti elektrone na 3p i 3s-paralele, uz daljnji prijelaz u 3d, što se čini valjanim. Kao rezultat toga, promjena nije samo u valenciji atoma, već u svim mogućim fazama oksidacije. To je broj značenja za povećanje, tako da je to broj riječi za učešće sirke.
Koraci oksidirane vode u danu
Možete vidjeti nekoliko glavnih opcija za ovaj indikator. Za sírki tse:
Među njima je najrjeđi razvoj S+2 i svuda su ružičasti. Od faze oksidirane vode na dnu do taloženja hemijske aktivnosti i oksidativnog zdravlja čitavog govora. Tako, na primjer, z'соединение z -2 - tse sulfidi. Imaju tipičan oksidirajući element.
Chim je označeni nivo oksidacije u okolini, sa više vrtložnog oksidativnog zdravlja kao rezultat volodya rechovina. Lako se ciom prevrnuti ako se daju dvije bazične kiseline koje će postaviti sirku:
- H 2 SO 3 - sirchista;
- H 2 SO 4 - sirčana.
Naizgled, ostalo je stabilnije, jače, što je veća koncentracija, još ozbiljnije za oksidaciju.
jednostavan razgovor
Jakov jednostavni govor sirka je prekrasan kristal iste vrste živog oblika. Ako želim samo jedan od oblika, onda postoje dva osnovna principa govora. Persha, monoclinna ili rombična - tse í zhovte je neprikladna za razchinyatsya u blizini vode, a lišena je u organskim prodavačima. Pogledajte hrskavost i lijep oblik strukture koju predstavlja kruna. Temperatura topljenja - blizu 110 0 S.
Ako ne propustite srednji trenutak kada se takve modifikacije učitavaju, tada možete odmah razviti inshy kamp - plastični sirku. Vona je viskozna smeđa boja poput gume, koja će se, kada se zagrije ili previše ohladi, ponovo pretvoriti u oblik dijamanta.
Ako pričate o hemijski čistoj sirki, sa kašnjenjem bagatoraza filtracije, eto, ima jako sitnih kristala, sklonosti i bešćutnih nepravilnosti u vodi. Zdatní se pobrinuti za kontakt s vologo i kisníy povítrya. Puno se bavim hemijom.

Znanje u prirodi
U prirodi postoje prirodni rodovi, od kojih postoje polovični, a to je sama po sebi jednostavna riječ. Osim toga, nema potrebe za osvetom:
- u mineralima, rudama i rudama;
- u organizmima tvarina, roslina i ljudi, pa kako ući u skladište organskih molekula;
- u prirodnim plinovima, nafti i nafti;
- u uljnim škriljcima i prirodnim vodama.
Možete imenovati mali broj rudara koji se nalaze na listi:
- kinovar;
- pirit;
- sphalerit;
- anti-novac;
- galena i ínshí.
Veliki je dio osvojenih sezona u godini na sirchanokysl virobnitstvu. Drugi dio je pobjednički u medicinske svrhe, vlada Silskoe, industrijski procesi i praksa govora.
Fizička snaga
Oni se mogu opisati u nekoliko tačaka.
- U vodi nije rozchinnaya, u ugljičnom disulfidu ili terpentinu - dobro je ići.
- Sa trivijalnim naribanim, nakupljam negativan naboj.
- Temperatura topljenja postaje 110 0 C.
- Temperatura ključanja 190 0 C.
- Kada dostigne 300 0 S, ide u liniju grebena, lako se sruši.
- Čisto govoreći, samo-posuđivanje energije je još bolje.
- Sam po sebi, miris praktički nije lak, međutim, voda i pola kolača vide oštar miris pokvarenih jaja. Tako i sam, kao i deyaki plinoviti binarni predstavnici.
Fizičku snagu datog govora Nasilnika ljudi su već dugo vidjeli. Sama zbog svoje zapaljivosti sírka í uzeo ime tako. U vikorisovyvuvuyu guše i isparavaju pare, kao što se oblikuju na vrućini dana, kao protiv neprijatelja. Osim toga, kiselost je također važnija od promiskuitetne vrijednosti za sudbinu ulja.

Vesele vlasti
Tema: "Syrka i íí̈ spoluky" u školskom kursu hemije pozajmica nije jedan čas, već kilka. Aje í̈kh duzhe bagato. To će biti objašnjeno hemijom ovog govora. Možete pokazati i moć oksidacije sa jačim prototipovima (metal, bor i ínshí), kao i sa više nemetala.
Međutim, njih nije briga za takvu aktivnost, samo sa fluorom u sprezi sa bilo kojom vrstom pameti. Za sve je potrebno grijanje. Moguće je identificirati niz kategorija govora, s kojima postoji veza između sljedećeg:
- bacio;
- nemetali;
- livade;
- jake oksidirajuće kiseline - sirčana i dušična.
Spoluki sirki: raznovodi
Njihova svestranost objasnit će se nejednakim vrijednostima stupnja oksidacije glavnog elementa - sirka. Dakle, možete vidjeti nekoliko glavnih tipova govora za bolje upoznavanje:
- faza oksidacije -2;
Ako pogledate klasu, a ne indikator valencije, tada će dati element popraviti takve molekule, kao što su:
- kiselina;
- oksid;
- sol;
- binarni spoluces sa nemetalima (sirkovugleti, hloridi);
- organski govor.
Sada možete vidjeti glavne od njih i staviti prst na njih.

Recovini sa korakom oksidacije -2
Spoluki sirki 2 - tse í̈í konformacije sa metalima, kao i sa:
- u uglju;
- gubimo se;
- fosfor;
- silicij;
- mish'yak;
- bor.
U cich vipadkah su prikazani u ulozi oksidacijskog sredstva, jer su svi elementi električni pozitivniji. Posebno ih je važno vidjeti.
- Sírkovulec - CS 2. Prozora rídina sa karakterističnom receptivnom aromom efírua. Ê otrovan, u plamenu i vibuhaê govor. Vikoristovuyutsya jak razchinnik, i za veliki broj vrsta ulja, masti, nemetala, srednje nitrata, smola i gume. Tu je i važan dio virobnosti šava komada - viskoznost. Obećanja su sintetizovana u velikom broju.
- Voda sulfidna ili sulfidna voda - H 2 S. Gas koji se ne može stvrdnuti i sladić za uživanje. Miris je oštar, na rubu neprihvatljiv, pokvareno jaje. Otruyny, vozio dyshal centar, tako da yak po'yazu íoni mídí. Za to, kada je odsečen, postoji dah i smrt. Široko se koristi u medicini, organskoj sintezi, sintezi organskih kiselina, a takođe iu svojstvu energetski vidljivog siruvina.
- Sulfidi metala se široko koriste u medicini, u sulfatnom alkoholu, odbačenim farmaceutskim proizvodima, u pripremljenim luminoforima i kod drugih miševa. Početna formula je Me x S y.

Povezivanje Zí korak oksidacije +4
Spoluks sirki 4 - sve važniji oksid i srodne soli i kiselina. Sav smrad se popunjava širokim šiljcima, što može biti značajnije u industriji. Može se činiti da dolazi do oksidacije, a češće da se manifestira nova snaga.
Formule sa poluzrnom sa korakom oksidacije +4 koraka:
- oksid - čisti gas SO 2;
- kiselina - čista H 2 SO 3;
- soli mi može dati formulu Me x (SO 3) y.
Jedan od najpopularnijih ê ili anhidrida. Vino je bezbarvinski govor, sa volodya mirisom grla sirnika. U sjajnim kupovinama, lako je namirisati kada postoje vulkani.
Lako se razgrađuje u vodi iz rastvora kiseline i sirchistoy. Vodi se, kao tipična so, u koju se ulazi na viglyadi sulfit-ion SO 3 2-. Tsey anhidrid je glavni plin koji se unosi u opstrukciju pomorske atmosfere. Samo vino se sipa u svetlo.
Z'соединение, u kojem se na sivim stepenicama oksidira +6
Na takvo priznanje, prvo za sve, je izraz anhidrida i sirhanske kiseline sa njenim solima:
- sulfati;
- hidrosulfati.
Dakle, kako se atom sirke u njima nalazi u vrhunsko oksidiranom stanju, onda je snaga cicha potpuno nula. Smrad je jako oksidirajući.
Serki (VI) oksid - sirchaniy anhidrid - je hlapljiv neplodni ridin. Karakteristika riže - jaka sposobnost upijanja vlage. Dimit na otvorenoj osnovi. Kada se toči u vodi, dajte jednu od najjačih mineralnih kiselina - sirčan. Koncentracije razlika í̈í̈ važno masno, blago žvakavo rídinoy. Ako u rastvoru sirhanske kiseline ima anhidrida, onda će ona biti posebno poznata, nazvana oleum. Win vikorystvutsya u industriji s virobnitství kiselinom.
Sered soli - sulfati - velika vrijednost maê takve spoluki, jak:
- kukovi CaSO 4 2H 2 O;
- barit BaSO 4;
- mirabilit;
- olovni sulfat i drugi.
Miriše na skladištenje u poslu, hemijske sinteze, lekove, pripremljene optičke dodatke i naočare i pronalaženje prehrambene industrije.
Poznato je da se hidrosulfat široko koristi u metalurgiji; A i sam smrad će pomoći da se veliki broj sklopivih oksida pretvori u različite sulfatne oblike, tako da se može naći u raznim vrstama.
Vivchennya sirki u školskom kursu hemije
Ako je najljepše naučiti znanje o onima koji su također sirka, kao što je moć moći, koje je djelo sirka? 9. razred - najljepši period. Nije samo uvo, jer je za djecu sve novo i tiho. Sredina je u vivchenna nauci o hemiji, ako će mi temelji, postavljeni ranije, pomoći da razumijem temu. Tom, da vidiš hranu, vidi samog prijatelja iz razreda. U isto vrijeme, cijela tema se proteže na niz blokova, u pojedinim okremoima se nalazi lekcija "S'соединение sírki. 9. razred".
To će biti objašnjeno broju ljudi. Također je dobra ideja pogledati ishranu o vitaminima i mineralima u industriji. Općenito, tema će biti uvedena u sredini 3 godine.
A osovina grožđa se mora naribati na vivchennya tek u 10. razredu, ako organizmi gledaju na hranu. Isto tako, smrad biologije u srednjoj školi će biti uništen. Adže sirka da uđe u skladište takvih organskih molekula, kao što su:
- tiospirti (Merkaptani);
- bílki (tretinska struktura, na kojoj je prikazan oblik disulfida místkív);
- tioaldegidiv;
- tiofenoli;
- tioefiri;
- sulfonske kiseline;
- sulfoksid i ínshí.
Njih vide u posebnoj grupi organosumpornih z'êdnan. Miris može biti važniji ne samo u biološkim procesima živih bića, već iu industriji. Na primjer, sulfonske kiseline su osnova mnogih lijekova (aspirin, sulfanilamid ili streptocid).
Osim toga, postoji trajna komponenta takvih stvari kao što su radnje:
- amino kiseline;
- fermenti;
- vitamini;
- hormoni.
Na sobnoj temperaturi voda ulazi u reakciju samo sa živom. Podešavanjem temperature aktivnost se značajno povećava. Prilikom zagrevanja sirka reaguje bez sredine jednostavnim frazama, iza vinjete unutrašnjih gasova, azota, selena, telurijuma, zlata, platine, iridijuma i joda. Sulfidni dušik i zlato uklanjaju se na indirektan način.
Angažman sa metalima
Syrka viyavlya oksidirana snaga, kao rezultat interakcije sulfida:
Vzaêmodia s vodom radi na 150-200°C:
H 2 + S = H 2 S.
Vzaêmodiya z kisnem
Voda gori u kiselini na 280°C, na okretu na 360°C, na kojoj se postavlja zbir oksida:
S + O 2 = SO 2;
2S + 3O 2 = 2SO 3.
Kombinacija sa fosforom i ugljem
Kada se zagrije bez pristupa struji, voda reagira s fosforom, ugljikom, pokazujući oksidacijsku moć:
2P + 3S = P 2 S 3;
Kombinacija sa fluorom
U prisustvu jakih oksidacionih sredstava manifestuje se sljedeća snaga:
S + 3F 2 = SF 6.
Vzaêmodiya sa preklopnim riječima
Kada se povezuje sa preklapajućim rečima sirke, to je kao olovo:
S + 2HNO 3 = 2NO + H 2 SO 4.
disproporcija reakcija
Syrka je dobra za nesrazmjerne reakcije, kada se uspostavi interakcija s livadom, sulfidi i sulfati:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. otrimannya sírki
Prirodne rude
Kada se zagreva bez pristupa hrani
FeS 2 = FeS + S.
Oksidacija vode u slučaju nedostatka kiselosti
2H 2 S + O 2 = 2S + 2H 2 O.
Iz plina ulazi u metalurške i koksne peći, kada se zagrije u prisustvu katalizatora
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. sirvodden
Vodneve z'êdnannya sirki - sirvodden H 2 S ... Sirevodn je kovalentna z'êdnannya. Molekuli su analogni molekulima vode, atom vode se nalazi u fazi sp 3-hibridizacije, ali molekuli vode ne prihvataju molekule vode. Atom sirkija je manje električki negativan, što je atom niži kiseli, što je manja veličina, manji je naboj, manji je naboj. Valentni rez HSH postaje 91,1°, a H - S pojas postaje 0,133 nm.
Fizička snaga
Sa ekstravagantnim umovima, sirvodden je gas bez gasa, sa jakim karakterističnim mirisom pokvarenih jaja. T pl = -86 °C, T bala = -60°C, trula u vodi, na 20°C u 100 g vode, rastvara se 2,58 ml H 2 S. Čak i razgranat, ako se udiše, pletenica je paralelna, što može dovesti do fatalnog rezultata. U prirodi se viđa u skladištima vulkanskih gasova, taloži se u gnitju rastućih i živih organizama. Dobra otopina u vodi, pri vježbanju ću popraviti slabu hlorovodoničnu kiselinu.
Vesele vlasti
Vodeni rastvor ima slabu snagu dvobazne kiseline:
H 2 S = HS - + H +;
HS - = S 2 + H +.
Sire voda za paljenje u povitri blakitnym half'am. U slučaju međusobnog pristupa, uspostavlja se važeći certifikat:
2H 2 S + O 2 = 2H 2 O + 2S.
Uz ogroman pristup ognjištu ognjišta, vodu treba proizvesti prije odobrenja oksida ulja (IV):
2H 2 S + 3O 2 = 2H 2 O + 2SO 2.
Sirkhoven je u stanju da isporuči snagu. Naslage vode mogu se oksidirati u vodenom rastvoru do suve vode, čistog gasa i sumporne kiseline.
Na primjer, in vitro bromna voda:
H 2 S + Br 2 = 2HBr + S.
zamjena sa hlornom vodom:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Može se ispaliti mlaz vode, vikorista i olovni oksid, tako da reakcija super vode može dovesti do velikih vrsta toplote:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
Vzaêmodia sírvodnyu sírchistim gas vikoristovuyutsya za uklanjanje sirki iz gasova, za ulazak u metaluršku i sirhansku kiselinu virobniztva:
SO 2 + 2H 2 S = 3S + 2H 2 O.
Proces zsim povezao je osvjetljavanje izvorne sirke tokom vulkanskih procesa.
Jednosatnim protokom čistog gasa i vode kroz livadu postavlja se tiosulfat:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
Sa normalnim umom, voda je gas bez čokoladice, pa čak i otrovan, sa karakterističnim mirisom pokvarenih jaja.
Za yogo otrymannya u laboratorijskim umovima poziva se da se u sulfid doda razrijeđena hlorovodonična kiselina:
Prvi način uklanjanja vode iz vode dodavanjem hladne vode aluminijum sulfidu:
Sirvodin, koji je na ovaj način odsečen, jasniji je.
Sirevodn je kovalentna z'êdnannya. Yogo molekuli mogu sakriti strukturu, sličnu strukturi molekula olova (Div. Rozd. 2.2). Međutim, s obzirom na molekule vode, molekuli vode ne odgovaraju vodenim zvukovima. Desno u tome, atom sivog je manje električno negativan, donji atom je kisel, ale je veće veličine. Zato atom vode može biti manje moćan od naboja, a ne atom kiseo. Kroz vidljivost vodovodnih priključaka snižavam temperaturu vode, snižavam vodu. Vidljivost zvukova vode u vodi će gadu objasniti razliku u vodi.
Vodeni rastvor ima slabu snagu dvobazne kiseline:
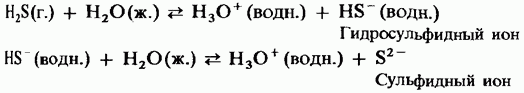
Voda će gorjeti u mraku polumase. Kada postoji neprekidni pristup vatri, voda se nadzire da se vidi vizija vatre, jer se kondenzuje na hladnoj površini terena:
Uz ogroman pristup peći, vodu treba proizvesti prije odobrenja sumpor-dioksida:
Sirkhoven je u stanju da isporuči snagu. Na primjer, vino iz barijevog broma vode i obnovljivo od njih do jona
Hidrohlorid je dvobazna kiselina koja se može koristiti za dvije serije soli - sulfidnu i hidrosulfidnu (razd. Vishche). Sulfidi stranih metala mogu se naći u blizini vode pomoću rastvora. Rezultat hidrolize:
Nerazorni sulfidi drugih metala mogu se istaložiti iz vodenih rastvora soli ovih metala, prolaskom kroz izlaz vode. Na primjer, ako se voda provuče kroz jaz, onda se mogu osvetiti crnom opsadom sulfida
Reakcija je pobjednička u kvaliteti analitičkog testa za vodu.
oksidi sirki
Sierka je odobrila niz oksida, od kojih su dva najznačajnija: sirki dioksid i sirka trioksid
Sumpor dioksid je bezalkoholni gas bez alkohola, oštrog zagušljivog mirisa. U laboratorijskim umovima, moguće ga je ukloniti, spaljivanjem u nekoj vrsti ili kiselini, dodavanjem toplih razblaženja varijacija kiseline nekoj nesulfitnoj soli ili zagrijavanjem koncentrirane kiseline iz sredine:
Serumski dioksid-kiseli oksid. Lako ga je razaznati po vodi, napunjenoj sirčistnom kiselinom. Kiselina rjeđe jonizuje i, osim toga, slaba je kiselina:
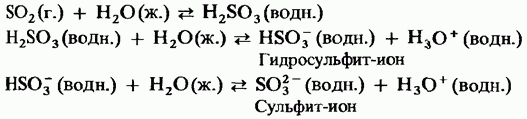
Kada se plinoviti sumpordioksid propušta kroz otopinu natrijum hidroksida, stvara se natrijum sulfit. Natrijum sulfit, koji reaguje sa suvišnim sumpordioksidom, dovodi natrijum hidrosulfit u analognu reakciju na ugljen dioksid u gaziranoj vodi.
í sumpor dioksid sličan gasu, í th rastvori na bazi vode su rođaci. Na primjer, plinoviti natrijum hidroksid je oksid iz otopine sulfata, a čista kiselina se dodaje jonu.
Sumpor dioksid u industrijskom otpadu se destiluje tokom vipalyuvannya na nekim sulfidnim rudama i postaje međuproizvod u procesu uklanjanja sirhanoične kiseline (Div. Poglavlje 7). Pšenični dioksid se skladišti u industriji celuloze, za uklanjanje tkanina, a takođe i za preradu voća i povrća u slučaju trivijalnog zberiganna.
Sumpor dioksid je vrlo važan u začepljenoj atmosferi, a posebno u osvjetljenju kiselih ploča. U atmosferi se vino oksidira u sumporov trioksid:
Kod normalnih umova, proces se s vremena na vrijeme suprotstavi, ali u prisustvu katalizatora moguće ga je riješiti, možda prije nego što se koristi u kontaktnom procesu uklanjanja kiseline. Male količine soli i mangana, koji se mogu naći u atmosferi, omogućavaju katalizaciju oksidiranog sumpor-dioksida. Sivi trioksid reaguje uz pomoć alkohola i zato se pojavljuju grimizni, jer su tablete kiseline (Div. Sozh Ch. 12).
Čvrsti sumpor trioksid je polimorfan. Dva navazhlivska oblika Prvi od njih je trimer sa cikličnom strukturom (slika 15.24, a); kristali pogleda. mê aciklična polimerna struktura (slika 15.24, b); Divno pri pogledu na gole kristale. Temperatura topljenja. U prisustvu vologa, korak po korak se pretvara u Obidvi oblik da ključa na 45°C. Parna para trioksida se skladišti u izolovanim simetričnim planarnim molekulima.
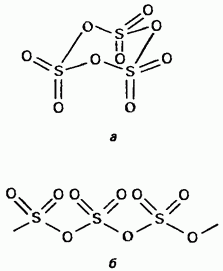
Mala. 15.24. Sirki trioksid, Aciklična struktura, b - Aciklična struktura.
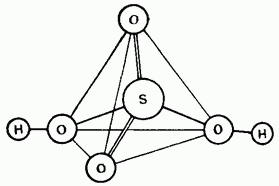
Mala. 15.25. Struktura molekula sirhanoične kiseline.
U laboratorijskim sudoperima, sumpor trioksid se ispušta sa zagrijanim sulfatom
Vodeni trioksid može biti jako kisel. Vino egzotermno reaguje sa vodom, pretvarajući kiselinu:
Syrka trioksid je jako oksidaciono sredstvo. Na primjer, vino oksidira bromovodonik u bromovodonik.
Sirchana acid
Sirčanska kiselina je jalova uljana kiselina ridina. Cijena je jedan od najvažnijih industrijskih kemijskih proizvoda. Njena promislova ítrimannya za dodatni proces kontakta í stasosuvannya je opisana u pogl. 7.
Nerazrijeđena sirhan kiselina je kovalentna otopina. Molekuli mogu biti tetraedarski budovi (slika 15.25).
Syrchanova kiselina za ključanje i razlaganje na 340°C,
Temperatura tačke ključanja je visoka, a viskozitet hlorovodonične kiseline je visok;
Syrchanova kiselina je jaka dvobazna kiselina. U vodi će voda porasti, a hidrosulfatni i sulfatni joni su odobreni:
Syrchana kiselina brine o sudbini svih reakcija karakterističnih za kiseline. Vona reagira s metalima, otapajući sulfate metala i vode, u reakcijama sa karbonatima, rastvorljivim sulfatima, dioksidima u ugljiku i vodi, te u reakcijama sa legurama i livadama, osiguravajući sulfate ili hidrosulfate.
Koncentrovana sirhan kiselina jače reaguje sa vodom. Radi razuma, sirchan kiselinu treba dodati sipanjem u vodu, a ne navpaki. Kiselina je higroskopna, tj. To í̈í̈ vikoristovuyut za sušenje gasova, jer ne reaguju s njim, prolazeći í̈kh kroz sirhan kiselinu. Udio sumporne kiseline u vodi i premazu je velik, ali sumporna kiselina može poslužiti kao sredstvo za dehidrataciju; za svaku koncentriranu sirhansku kiselinu:
bijeli kristali u pentahidrat sulfat pretvaraju bezvodni sulfat
u ugljikohidratima, na primjer saharozi, ugljenisane su:
papir se može karbonizirati kombinacijom koncentrirane organske kiseline, koja se akumulira s dozom kiseline na celuloznim vlaknima;
etanol se pretvara u etilen:
(Dehidracija etanola uz pomoć organske kiseline, koju treba provoditi pod kontrolom
umovi, da proizvode etoksietan (dijetalni eter) do odobrenja i da reakcija bude pobjednička za eliminaciju etoksietana u industrijskom obimu);
zbir hlorobenzena i trihloretanala (hlorala) podleže dehidraciji (razd. odeljak 16.3).
Koncentrovana sirhan kiselina je jako oksidaciono sredstvo. Osvojio oksidirajući metale i nemetale. između ostalog
Yak ínshí guza, kako ínstruyuyut oksidacionu moć koncentrirane sirhanoične kiseline, također oksidira ione u ione, kao i bromid-jone u virusni brom u nastupu reakcija:
Nareshty, sirchan kiselina vikorizira kao sulfonirajući agens u organskoj hemiji (div. Ch. 17).
Sulfati, sulfati i tiospoluci
Sulfat-ion ima tetraedarsku strukturu, sličnu strukturi molekula sumporne kiseline.
Soli. Sulfat se uspostavlja u reakcijama razrijeđene sirhanoične kiseline s metalima, oksidima, hidroksidima i karbonatima. Za vino sulfat bar i ínshí sulfat roschinní na vodi. Kalcijum sulfat nije jako jak u vodi. Odreske prije zagrijavanja promiješajte sulfatom. Vinnyts u cijeloj raznolikosti sulfat zaliza. Na primjer, sulfat se, kada se zagrije, taloži s odobrenim oksidom soli:
Za obnavljanje sulfatnih jona na bilo koji način, dodajte pritisak vode u hloridnu šipku. Ako u preliminarnim utakmicama postoje dokazi o sulfatnim ionima, kao rezultat toga, uspostavit će se opsada sulfatnog barija:
Sulfati mogu biti veoma važni u zasosuvanu. Na primjer, magnezijev sulfat (engleski sil, girka sil) koristi se za virobničenje vibuhovih rijeka, za pripremu sirnika i vatrostalnih tkanina. Nasicheni razchin tsíêí̈ soli vikoristovutsya u medicinskoj praksi kao protivopalny zasíb.
Natrijum tiosulfat se može posmatrati kao analog natrijum sulfata, u kojem je jedan atom supstituisan za jedan atom sumpora. Među djecom Tíospoluke, oni će smisliti jednu stvar - tiocianat kaliyu. Vin je analog cijanatnog kalijuma. Tíocianat kalíyu se može odbaciti, spajajući cyaníd kalíyu sa sírkoyu:
Tiocianat kaliyu vikoristovuyutsya u yak_síaníníy kalíy za proizvodnju prije početka krivo
Opet, ponovite ponovo!
1. Prilikom prelaska na niži dio VI kategorije kvaliteta, elementi postepeno prelaze iz nemetalnih u metalik.
2. Elementi VI grupe mogu sakriti zgradu vodom i reakcionim metalima, postavljajući pozornicu u kojoj smrad može biti oksidiranih stepenica -2.
3. Kisen je visoko elektronegativna i jaka oksidirajuća moć.
4. Ozon još jače oksidira, manje kiseli.
5. Kisen ima izuzetno važnu ulogu u biološkim sistemima;
6. Kisen se odobrava sa malim spolucima binarnog spoluca, oksida različitih vrsta:

7. Vodeni peroksid ê je jako oksidaciono sredstvo.
8. Syrka u viglyadi može se naći u decilkoh enantiotropnim oblicima.
9. Za odbacivanje vode od opterećenja tla, proces Frash-a je stagniran, u kom slučaju je teško zaglaviti i pregrijana para.
10. Sirka je postavljena na poluvrijeme, u kojem su u kampovima sa nivoima oksidacije +2, +4, +6 í -2.
11. Sirwater je slaba dvobazna kiselina i dominantna.
12. Gasni sumpordioksid i rastvori na bazi vode.
13. Vodeni trioksid može biti jako kiseo i oksidiran.
14. Syrchan kiselina je jaka dvobazna kiselina, sredstvo za sušenje, sredstvo za dehidrataciju i jako oksidaciono sredstvo.
15. Molekuli hlorovodonične kiseline i sulfat-jona mogu imati tetraedarsku strukturu.