مركبات الكبريت. درجة أكسدة الكبريت في المركبات. صيغ مركبات الكبريت. الكبريت. كبريتيد الهيدروجين. كبريتيد
الكبريت ، خواصه الفيزيائية والكيميائية. القيمة البيولوجية للكبريت ، وتطبيقه (إزالة الدمغ).
سيرا في الطبيعة
الكبريت الأصلي
برنامج تلفزيوني - تألق الرصاص
النحاس 2 ثانية - تألق النحاس
ZnS - مزيج الزنك
فاس 2 - البايرايت ، والكبريت البايرايت ، القط الذهب
H 2 ثانية - كبريتيد الهيدروجين (في المصادر المعدنية والغاز الطبيعي)
كاسو 4 * 2H2 O- الجبس
MgSO 4 * 7H2 O - ملح مرير (انجليزي)
Na 2 SO 4 * 10 H 2 O - ملح غلوبر (ميرابيليت)
الخصائص الفيزيائية
المادة البلورية الصلبة صفراء ، غير قابلة للذوبان في الماء ، لا تبلل بالماء (تطفو على السطح) ، t ° kip = 445 درجة مئوية.
واحدة من الخصائص الفيزيائية الخاصة للكبريتطفوقدرة مسحوق الكبريت الناعم على التعويم ، حيث تغرق بلوراته الكبيرة في الماء. والحقيقة هي أن الكبريت لا يتم ترطيبه بواسطة الماء ، ويتم الاحتفاظ بجزيئاته على سطح الماء بسبب فقاعات الهواء الصغيرة الملتصقة بها.تستخدم هذه الخاصية في فصل الكبريت الأصلي عن الشوائب. قم بطحن الخام ، واملأه بالماء ، وقم بنفخه من الأسفل بالهواء ، ويطفو الكبريت للأعلى ، وتبقى الشوائب في القاع.التآصل
يتميز الكبريت بالعديد من التعديلات الخاملة., لكن التعديلات الأكثر شهرة هي:معيني الشكل (بلوري) , أحادي الميلان (إبرة) و البلاستيك .
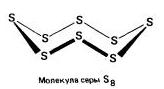
المعينية (الكبريت) - S 8
t ° pl. = 113 درجة مئوية ؛ ρ = 2.07 جم / سم 3. التعديل الأكثر استقرارا.
أحادي الميل (ب - الكبريت) - S 8
الإبر الصفراء الداكنةt ° pl. = 119 درجة مئوية ؛ ρ = 1.96 جم / سم 3. مستقرة في درجات حرارة أكثر من 96 درجة مئوية ؛ في ظل الظروف العادية يتحول إلى المعينية.
البلاستيك S ن
كتلة مطاطية بنية (غير متبلرة). غير مستقر ، عندما يتحول إلى صلب المعينية.
إنتاج الكبريت البلاستيك
هيكل ذرة الكبريت
وضع الإلكترونات حسب المستويات والمستويات الفرعية
حالة الأرض
1s 2 2s 2 2p 6 3s 2 3p 4
وضع الإلكترون بواسطة
المدارات (الطبقة الأخيرة)درجة
أكسدةتكافؤ
في حالة أساسية
الدولة متحمس الأولى
الدولة الثانية متحمس
إنتاج الكبريت
1. الطريقة الصناعية - الصهر من الخام باستخدام بخار الماء.
2. أكسدة غير كاملة من كبريتيد الهيدروجين (مع نقص الأكسجين).
2H 2 S + O 2 = 2S + 2H 2 O
3. رد فعل Wackenroder
2H 2 S + SO 2 = 3S + 2H 2 O
الخواص الكيميائية للكبريت
الكبريت هو عامل مؤكسد S 0 + 2ē→ S -2 | كبريت - عامل الاختزال: S - 4ē→ S +4 ؛ S - 6ē→ S +6 |
1. تفاعل الكبريت معجميع المعادن الأرضية القلوية والقلوية والنحاس والزئبق والفضة بدون تدفئة: 2 Na + S→ نا 2 اس EXPERIENCE S + Hg = HgS الزئبق لديه تقلب عالية. الأزواج لها سامة. يكمن رد الفعل هذا في إزالة الزئبق والتخلص منه ، على سبيل المثال ، من مقياس حرارة طبي مكسور. الأماكن التي يستحيل فيها استخراج قطرات الزئبق مغطاة بمسحوق الكبريت. يتفاعل الكبريت والزئبق عند لمسه. نتيجة لذلك ، تتشكل مادة خاملة كيميائية وغير ضارة. وتسمى هذه العملية demercurization. 2. تفاعل الكبريتج المعادن الأخرى (باستثناءAu، Pt) عند درجة حرارة مرتفعة: 2Al + 3S تي → آل 2 S 3 Zn + S تي
°
→
تجربة ZnS Cu + S تي
→
تجربة CuS 3. تفاعل الكبريت مع بعض غير المعادن لتشكيل المركبات الثنائية: ح 2 + ق→ ح 2 ق 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. تفاعل الكبريت مع الأكسجين: S + O 2 تي ° → S +4 O 2 2 S + 3 O 2 t ° حزب العمال → 2 S +6 O 3 2. تفاعل الكبريتج الهالوجينات (باستثناء اليود): S + Cl 2→ S +2 Cl 2 ** تفاعل الكبريت مع الأحماض - العوامل المؤكسدة: S + 2H 2 SO 4 (conc)→ 3S + 4 O 2 + 2H 2 O S + 6HNO 3 (conc)→ H 2 S +6 O 4 + 6NO 2 + 2H 2 O ** ردود فعل عدم التناسب: 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
تطبيق
تفلك المطاط ، الحصول على الإيبونيت ، إنتاج المباريات ، البارود ، في مكافحة آفات الزراعة ، للأغراض الطبية (مرهم الكبريت لعلاج أمراض الجلد) ، للحصول على حمض الكبريتيك ، إلخ.
الواجب المنزليالفقرة 21 ؛ تمارين 1 ، 3 ، 4 ص. 99-100.
درجات إضافية
أكمل معادلات التفاعل ، ص رتب المعاملات باستخدام طريقة التوازن الإلكتروني ، حدد المؤكسد ، مما يقلل من عامل.
№2. تنفيذ التحول وفقا للمخطط:
هذا مثير للاهتمام ...
- محتوى الكبريت في جسم الإنسان يزن 70 كجم - 140 جم.
- يحتاج الشخص إلى 1 غرام من الكبريت يوميًا.
- البازلاء والفول والشوفان والقمح واللحوم والأسماك والفواكه وعصير المانجو غنية بالكبريت.
- الكبريت جزء من الهرمونات والفيتامينات والبروتينات ، وهو في الأنسجة الغضروفية والشعر والأظافر. مع نقص الكبريت في الجسم ، هناك هشاشة الأظافر والعظام ، تساقط الشعر.
راقب صحتك!هل تعلم ..
- يمكن أن تعمل مركبات الكبريت كعقاقير ؛
- الكبريت - أساس مرهم لعلاج الأمراض الجلدية الفطرية ، لمكافحة الجرب. ثيوسلفات الصوديوم Na 2 S 2 O 3 تستخدم لمكافحته.
- تحتوي العديد من أملاح حامض الكبريتيك على ماء التبلور: ZnSO 4 × 7H 2 O و CuSO 4 × 5H 2 أ. تستخدم كمطهرات لرش النباتات ولخلع الحبوب في مكافحة آفات الزراعة.
- فيتريول الحديد 4 × 7H 2 يستخدم O لفقر الدم.
- باسو 4 تستخدم للفحص الشعاعي للمعدة والأمعاء.
- البوتاسيوم الألومنيوم الشب KAI (SO 4) 2 × 12H 2 يا - مرقئ مع التخفيضات.
- المعدنية Na 2 SO 4 × 10H 2 يُطلق على O اسم "ملح Glauber's" تكريما للكيميائي الألماني Glauber I.R Glauber الذي اكتشفه في القرن الثامن عشر ومرضه فجأة أثناء رحلته. لم يستطع أن يأكل أي شيء ، رفضت معدته أن تأكل. أرسله أحد السكان المحليين إلى المصدر. بمجرد أن شرب الماء المالح المرير ، بدأ على الفور في تناول الطعام. التحقيق Glauber هذا الماء ، تبلور الملح Na منه. 2 SO 4 × 10H 2 A. يستخدم الآن كمسهل في الطب ، في صباغة الأقمشة القطنية. الملح يجد أيضا استخدام في صناعة الزجاج.
- تمتلك Yarrow قدرة متزايدة على استخراج الكبريت من التربة وتحفيز امتصاص هذا العنصر مع النباتات المجاورة.
- يطلق الثوم مادة - البوكيد ، مركب الكبريت الكاوي. هذه المادة تمنع السرطان ، تبطئ الشيخوخة ، تمنع أمراض القلب.
تشتمل المجموعة الفرعية للكالكوجين على الكبريت - وهذا هو الثاني من العناصر القادرة على تكوين عدد كبير من رواسب الخام. الكبريتات ، الكبريتيدات ، الأكاسيد وغيرها من مركبات الكبريت منتشرة على نطاق واسع ، وهي مهمة في الصناعة والطبيعة. لذلك ، في هذه المقالة نعتبر ما هي ، ما هو الكبريت نفسه ، جوهرها البسيط.
الكبريت وخصائصه
هذا العنصر لديه الموقف التالي في النظام الدوري.
- المجموعة السادسة ، المجموعة الفرعية الرئيسية.
- الفترة الصغيرة الثالثة.
- الكتلة الذرية هي 32.064.
- الرقم التسلسلي هو 16 ، وعدد البروتونات والإلكترونات هو نفسه ، وهناك أيضًا 16 نيوترون.
- يشير إلى العناصر غير المعدنية.
- تقرأ الصيغة "es" ، اسم عنصر الكبريت ، الكبريت اللاتيني.
في الطبيعة ، هناك أربعة نظائر مستقرة لها أعداد كتل 32،33،34 و 36. هذا العنصر هو السادس الأكثر وفرة في الطبيعة. ينتمي إلى العناصر الغذائية ، كجزء من الجزيئات العضوية الهامة.
الهيكل الإلكتروني للذرة
تدين مركبات الكبريت بتنوعها لخصائص التركيب الإلكتروني للذرة. يتم التعبير عنها بواسطة صيغة التكوين التالية: 1s 2 2s 2 2p 6 3s 2 3p 4.
يعكس الإجراء أعلاه الحالة الثابتة للعنصر فقط. ومع ذلك ، فمن المعروف أنه إذا تم إخطار الذرة بالطاقة الإضافية ، فيمكن حينئذٍ فصل الإلكترونات في المستويات الفرعية 3p و 3s ، مع الانتقال التالي التالي إلى ثلاثي الأبعاد ، والذي يبقى حراً. نتيجة لذلك ، لا يتغير تكاثر الذرة فحسب ، ولكن أيضًا كل حالات الأكسدة المحتملة. يزداد عددهم بشكل كبير ، وكذلك عدد المواد المختلفة مع الكبريت.
درجات أكسدة الكبريت في المركبات
هناك العديد من الخيارات الرئيسية لهذا المؤشر. بالنسبة للكبريت:
من بين هؤلاء ، S +2 نادر للغاية ، والباقي منتشر في كل مكان. تعتمد درجة أكسدة الكبريت في المركبات على النشاط الكيميائي والقدرة المؤكسدة للمادة بأكملها. على سبيل المثال ، المركبات التي تحتوي على -2 هي كبريتيد. في نفوسهم ، العنصر الذي نظرنا فيه هو عامل مؤكسد نموذجي.
كلما زادت درجة الأكسدة في المركب ، زادت وضوح قدرة التأكسد للمادة. يمكن ملاحظة ذلك بسهولة إذا استدعى الحمضين الأساسيين اللذين يتشكل منهما الكبريت:
- H 2 SO 3 - الكبريت.
- H 2 SO 4 - الكبريت.
من المعروف أن هذا الأخير هو مركب أكثر ثباتًا وقوة ، ويمتلك بتركيزات عالية قدرة أكسدة خطيرة للغاية.
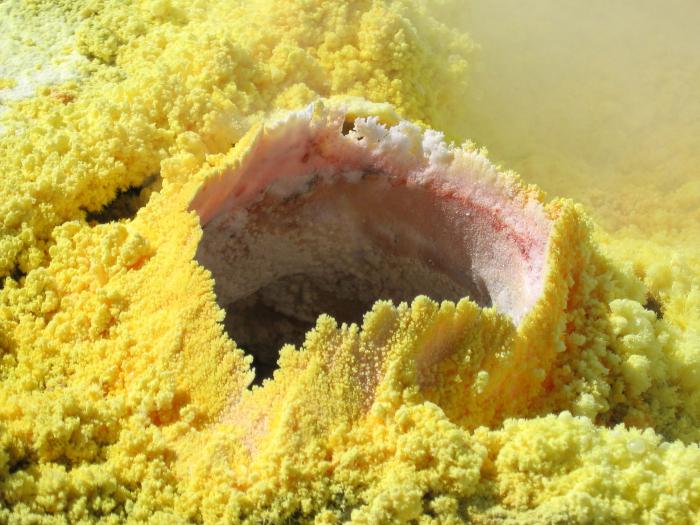
مادة بسيطة
كمادة بسيطة ، يمثل الكبريت بلورات صفراء جميلة ذات شكل ممدود منتظم. على الرغم من أن هذا ليس سوى شكل من أشكاله ، لأن هناك مادتين رئيسيتين. أول واحد ، أحادي أو معيني ، أصفر اللون لا يمكن إذابته في الماء ، ولكن فقط في المذيبات العضوية. يختلف في هشاشة الشكل الجميل للهيكل ، ويتم تقديمه على شكل تاج. نقطة الانصهار - حوالي 110 درجة مئوية
إذا لم تفوت الوقت الوسيط عند تسخين مثل هذا التعديل ، فيمكنك اكتشاف حالة أخرى في الوقت المناسب - الكبريت البلاستيكي. إنه محلول لزج مطاطي ذو لون بني ، والذي يتحول مرة أخرى إلى شكل معيني بعد التسخين أو التبريد السريع.
إذا تحدثنا عن الكبريت النقي كيميائياً ، والذي تم الحصول عليه عن طريق الترشيح المتكرر ، فهو بلورات صغيرة صفراء زاهية وهشة وغير قابلة للذوبان في الماء تمامًا. القدرة على الاشتعال عند ملامسة الرطوبة والأكسجين في الهواء. تختلف في النشاط الكيميائي عالية إلى حد ما.

يجري في الطبيعة
في الطبيعة ، هناك رواسب طبيعية تستخرج منها مركبات الكبريت وهي في حد ذاتها مادة بسيطة. بالإضافة إلى ذلك ، أنه يحتوي على:
- في المعادن والخامات والصخور.
- في جسم الحيوانات والنباتات والبشر ، كجزء من العديد من الجزيئات العضوية ؛
- في الغازات الطبيعية والنفط والفحم.
- في الصخور القابلة للاحتراق والمياه الطبيعية.
بعض المعادن الغنية بالكبريت هي:
- الزنجفر.
- البيريت.
- سفاليرايت.
- stibnite.
- غالينا وغيرها.
يذهب معظم الكبريت المنتج اليوم إلى إنتاج الكبريتات. يستخدم جزء آخر للأغراض الطبية ، الزراعة ، العمليات الصناعية لإنتاج المواد.
الخصائص الفيزيائية
يمكن وصفها في عدة نقاط.
- إنه غير قابل للذوبان في الماء ، في ثاني كبريتيد الكربون أو التربنتين - يذوب جيدًا.
- مع الاحتكاك لفترات طويلة يتراكم شحنة سالبة.
- درجة انصهار 110 درجة مئوية.
- درجة الغليان 190 0 درجة مئوية
- عندما تصل إلى 300 درجة مئوية ، يصبح سائلاً ، وسهل الحركة.
- مادة نقية يمكن أن تشعل خصائص قابلة للاحتراق جيدة جدا.
- الرائحة نفسها ليس لها أي تأثير تقريبًا ، ولكن مركبات الهيدروجين من الكبريت تنبعث منها رائحة حادة من البيض الفاسد. تماما مثل بعض ممثلي ثنائي الغازية.
الخصائص الفيزيائية للمادة المعنية معروفة لدى الناس منذ العصور القديمة. إن هذا الكبريت قد تلقى هذا الاسم بالتحديد بسبب قابليته للاشتعال. في الحروب ، استخدموا الأبخرة السامة الخانقة ، والتي تتشكل أثناء احتراق هذا المركب ، كسلاح ضد الأعداء. بالإضافة إلى ذلك ، كانت للأحماض التي تحتوي على الكبريت أيضًا أهمية صناعية مهمة دائمًا.

الخواص الكيميائية
الموضوع: "الكبريت ومركباته" في مقرر الكيمياء المدرسية لا يأخذ درسًا واحدًا ، بل درسًا آخر. بعد كل شيء ، الكثير منهم. هذا بسبب النشاط الكيميائي للمادة. يمكن أن تظهر خواص مؤكسدة مع عوامل اختزال أقوى (المعادن ، البورون ، إلخ) ، وتقليل الخواص مع معظم المواد غير المعدنية.
ومع ذلك ، على الرغم من هذا النشاط ، فقط مع الفلور ، يستمر التفاعل في الظروف العادية. جميع الآخرين تتطلب التدفئة. هناك عدة فئات من المواد التي يمكن أن يتفاعل الكبريت معها:
- المعادن.
- غير المعادن؛
- القلويات.
- الأحماض المؤكسدة القوية - الكبريتيك والنتريك.
مركبات الكبريت: الأصناف
سيتم تفسير تنوعها من خلال القيمة غير المتساوية لدرجة أكسدة العنصر الرئيسي - الكبريت. لذلك ، يمكنك تحديد عدة أنواع رئيسية من المواد لهذه الميزة:
- المركبات مع حالة الأكسدة -2 ؛
إذا أخذنا في الاعتبار الفئات ، وليس مؤشرا على التكافؤ ، فإن هذا العنصر يشكل جزيئات مثل:
- حامض.
- أكاسيد.
- الملح.
- المركبات الثنائية مع غير المعادن (ثاني كبريتيد الكربون ، الكلوريد) ؛
- المواد العضوية.
الآن النظر في أهمها وإعطاء أمثلة.

المواد مع حالة الأكسدة -2
مركبات الكبريت 2 هي مطابقاتها للمعادن ، وكذلك مع:
- الكربون؛
- الهيدروجين.
- الفوسفور.
- السيليكون.
- الزرنيخ.
- البورون.
في هذه الحالات ، يعمل كعامل مؤكسد ، حيث أن جميع العناصر المدرجة أكثر إيجابية. النظر في أهم منهم.
- ثاني كبريتيد الكربون - CS 2. سائل صاف مع رائحة لطيفة مميزة من الأثير. انها سامة ، قابلة للاشتعال والانفجار. يستخدم كمذيب ، وبالنسبة لمعظم أنواع الزيوت والدهون غير المعدنية والنترات الفضية والراتنجات والمطاط. كما أنه جزء مهم في إنتاج الحرير الصناعي. في الصناعة توليفها بكميات كبيرة.
- كبريتيد الهيدروجين أو كبريتيد الهيدروجين - H 2 S. الغاز الذي لا لون له وطعمه الحلو. رائحة حادة ، غير سارة للغاية ، ويذكر بيضة فاسدة. سام ، يخفض مركز التنفس ، لأنه يربط أيونات النحاس. لذلك ، إذا تسمم ، فإنه يخنق ويموت. يستخدم على نطاق واسع في الطب ، التوليفات العضوية ، إنتاج حمض الكبريتيك ، وأيضاً كمواد خام موفرة للطاقة.
- تستخدم الكبريتيدات المعدنية على نطاق واسع في الطب ، وفي إنتاج الكبريتات ، وإنتاج الدهانات ، وصناعة الفوسفور وغيرها من الأماكن. الصيغة العامة هي Me x S y.

المركبات مع حالة الأكسدة +4
مركبات الكبريت 4 هي أكسيد وأملاح وأحماض مماثلة. كلهم مركبات شائعة جدًا لها قيمة معينة في الصناعة. يمكن أن تعمل كعوامل مؤكسدة ، ولكن في كثير من الأحيان تظهر خصائص الحد.
الصيغ لمركبات الكبريت مع حالة الأكسدة +4 هي كما يلي:
- أكسيد ثاني أكسيد الكبريت SO 2؛
- حامض الكبريتيك H 2 SO 3؛
- الأملاح لها الصيغة العامة Me x (SO 3) y.
واحدة من الأكثر شيوعا هو أو أنهيدريد. انها مادة عديمة اللون مع رائحة مباراة محترقة. في التجمعات الكبيرة التي تشكلت أثناء ثوران البراكين ، من السهل في هذه اللحظة تحديد الرائحة.
يذوب في الماء مع تشكيل حامض الكبريتيك بسهولة تتحلل. يتصرف كأشكال ملح نموذجية ، والتي هي في شكل أيون كبريتيت SO 3 2-. هذا الأنهيدريد هو الغاز الرئيسي الذي يؤثر على تلوث الغلاف الجوي المحيط. هذا هو الذي يؤثر على التعليم ، ويستخدم في الصناعة في إنتاج الكبريتات.
المركبات التي يكون للكبريت فيها حالة أكسدة +6
وتشمل هذه ، قبل كل شيء ، أنهيدريد الكبريتيك وحمض الكبريتيك مع أملاحهما:
- الكبريتات.
- كبريتات الهيدروجين.
نظرًا لأن ذرة الكبريت فيها مؤكسدة للغاية ، فإن خصائص هذه المركبات قابلة للتفسير تمامًا. هم عوامل مؤكسدة قوية.
أكسيد الكبريت (السادس) - أنهيدريد الكبريتيك - سائل متقلب وعديم اللون. ميزة مميزة هي قدرة المجففة قوية. في الهواء الطلق يدخن. عندما يذوب في الماء يعطي واحدة من أقوى الأحماض المعدنية - الكبريتيك. المحلول المركز هو سائل زيتي كثيف مصفر قليلاً. إذا تم إذابة أنهيدريد في حمض الكبريتيك ، فستحصل على مركب خاص يسمى الزيت. يتم استخدامه في الصناعة لإنتاج الحمض.
بين الأملاح - الكبريتات - المركبات مثل:
- الجبس CaSO 4 · 2H 2 O ؛
- الباريت باسو 4 ؛
- الأملاح.
- كبريتات الرصاص وغيرها.
يتم استخدامها في البناء والتوليف الكيميائي والطب وصناعة الأجهزة البصرية والنظارات وحتى صناعة المواد الغذائية.
تستخدم المواد الهيدروكربونية على نطاق واسع في المعادن ، حيث يتم استخدامها كتدفق. كما أنها تساعد على ترجمة العديد من الأكاسيد المعقدة إلى أشكال كبريتات قابلة للذوبان ، والتي تستخدم في الصناعات ذات الصلة.
دراسة الكبريت في مقرر الكيمياء بالمدرسة
عندما يكون من الأفضل للطلاب أن يتعلموا ما هو الكبريت ، ما هي خصائصه ، ما هو مركب الكبريت؟ الصف 9 - أفضل فترة. ليست هذه هي البداية عندما يكون كل شيء جديدًا وغير مفهوم للأطفال. هذه هي النقطة الأساسية في دراسة العلوم الكيميائية ، عندما تساعد الأسس التي وضعت سابقًا في فهم الموضوع بالكامل. لذلك ، يتم تخصيص النصف الثاني من الفصل الأول للنظر في هذه القضايا. في الوقت نفسه ، يتم تقسيم الموضوع بأكمله إلى عدة كتل ، حيث يقف الدرس "مركبات الكبريت. الصف 9" بشكل منفصل.
هذا بسبب تعددها. كما تناول بشكل منفصل قضية إنتاج حامض الكبريتيك في الصناعة. بشكل عام ، يتم تخصيص 3 ساعات في المتوسط لهذا الموضوع.
ولكن يتم إخراج الكبريت للدراسة فقط في الصف العاشر ، عند دراسة القضايا العضوية. كما أنها تتأثر البيولوجيا في المدرسة الثانوية. بعد كل شيء ، الكبريت جزء من الجزيئات العضوية مثل:
- thyspirits (thiols) ؛
- البروتينات (بنية ثلاثية ، والتي تشكل جسور ثاني كبريتيد) ؛
- thioaldehydes.
- thiophenols.
- ثيو إستر.
- أحماض السلفونيك
- سلفوكسيدات وغيرها.
وهي تتميز في مجموعة خاصة من مركبات الكبريت العضوي. إنها مهمة ليس فقط في العمليات البيولوجية للكائنات الحية ، ولكن أيضًا في الصناعة. على سبيل المثال ، الأحماض السلفونية هي أساس العديد من الأدوية (الأسبرين ، السلفوناميد ، أو الستربتوسيد).
بالإضافة إلى ذلك ، يعتبر الكبريت مكونًا دائمًا للمركبات مثل:
- الأحماض الأمينية
- الانزيمات.
- الفيتامينات.
- الهرمونات.
في درجة حرارة الغرفة ، يتفاعل الكبريت فقط مع الزئبق. مع زيادة درجة الحرارة ، يزيد نشاطها بشكل كبير. عند تسخينه ، يتفاعل الكبريت مباشرة مع العديد من المواد البسيطة ، باستثناء الغازات الخاملة والنيتروجين والسيلينيوم والتيلوريوم والذهب والبلاتين والإيريديوم واليود. يتم الحصول على كبريتيد النيتروجين والذهب بشكل غير مباشر.
التفاعل مع المعادن
يعرض الكبريت خصائص مؤكسدة ، نتيجة للتفاعل ، تتشكل الكبريتيدات:
التفاعل مع الهيدروجين يحدث في 150-200 درجة مئوية:
H 2 + S = H 2 S.
التفاعل مع الأكسجين
يحترق الكبريت في الأكسجين عند 280 درجة مئوية ، وفي الهواء عند 360 درجة مئوية ، ويتكون خليط من الأكاسيد:
S + O 2 = SO 2 ؛
2S + 3O 2 = 2SO 3.
التفاعل مع الفوسفور والكربون
عندما يتم تسخينه بدون هواء ، يتفاعل الكبريت مع الفسفور والكربون ، ويظهر خصائص مؤكسدة:
2P + 3S = P 2 S 3 ؛
تفاعل الفلورين
في وجود عوامل مؤكسدة قوية يسلك خصائص مخفضة:
S + 3F 2 = SF 6.
التفاعل مع المواد المعقدة
عند التفاعل مع المواد المعقدة ، يتصرف الكبريت كعامل اختزال:
S + 2HNO 3 = 2NO + H 2 SO 4.
رد فعل عدم التناسب
الكبريت قادر على التفاعلات غير المتناسبة ، عند التفاعل مع الكبريتيدات القلوية وتشكيل الكبريتيت:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. إنتاج الكبريت
من الخامات الأصلية
عند تسخين البايرايت دون الوصول إلى الهواء
FeS 2 = FeS + S.
أكسدة كبريتيد الهيدروجين مع نقص الأكسجين
2H 2 S + O 2 = 2S + 2H 2 O.
من غازات أفران التعدين وفحم الكوك ، عند تسخينها في وجود محفز
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. كبريتيد الهيدروجين
مركب كبريت الهيدروجين - كبريتيد الهيدروجين H 2 S . كبريتيد الهيدروجين مركب تساهمي. يشبه تركيب الجزيء بنية جزيء الماء ؛ ذرة الكبريت في حالة التهجين sp 3 ؛ ومع ذلك ، وعلى عكس الماء ، لا تشكل جزيئات كبريتيد الهيدروجين روابط هيدروجينية فيما بينها. ذرة الكبريت أقل إلكترونيا من ذرة الأكسجين ، ولها حجم أكبر ، ونتيجة لذلك ، تكون كثافة الشحن أقل. زاوية التكافؤ HSH هي 91.1 درجة ، وطول السندات H - S هو 0.133 نانومتر.
الخصائص الفيزيائية
في ظل الظروف العادية ، يعد كبريتيد الهيدروجين غازًا عديم اللون ، وله رائحة مميزة قوية من البيض الفاسد. تي ر = -86 درجة مئوية تي kip = -60 درجة مئوية ، ضعيف الذوبان في الماء ، عند 20 درجة مئوية ، يذوب 2.58 مل من H2S في 100 غرام من الماء. في الطبيعة ، يتم إطلاقه في تكوين الغازات البركانية ، التي شكلتها تحلل الكائنات الحية النباتية والحيوانية. وهو قابل للذوبان في الماء ، عندما يشكل الذائب حمض كبريتيد الهيدروجين الضعيف.
الخواص الكيميائية
في محلول مائي ، يحتوي كبريتيد الهيدروجين على خصائص حمض ديباسيك ضعيف:
H 2 S = HS - + H + ؛
HS - = S 2- + H +.
كبريتيد الهيدروجين حرق في الهواء الشعلة الزرقاء. مع وصول الهواء المحدود ، يتم تشكيل الكبريت المجاني:
2H 2 S + O 2 = 2H 2 O + 2S.
مع وصول الهواء الزائد ، يؤدي احتراق كبريتيد الهيدروجين إلى تكوين أكسيد الكبريت (IV):
2H 2 S + 3O 2 = 2H 2 O + 2 SO 2.
كبريتيد الهيدروجين له خصائص مخفضة. حسب الظروف ، يمكن أكسدة كبريتيد الهيدروجين في محلول مائي للكبريت وثاني أكسيد الكبريت وحمض الكبريتيك.
على سبيل المثال ، يغير لون الماء من البروم:
H 2 S + Br 2 = 2HBr + S.
يتفاعل مع ماء الكلور:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
يمكن إشعال نفاثة من كبريتيد الهيدروجين باستخدام ثاني أكسيد الرصاص ، لأن التفاعل يكون مصحوبًا بإطلاق حرارة كبير:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
تفاعل كبريتيد الهيدروجين مع ثاني أكسيد الكبريت تستخدم لإنتاج الكبريت من غازات النفايات من إنتاج المعادن والكبريتات:
SO 2 + 2H 2 S = 3S + 2H 2 O.
يرتبط تكوين الكبريت الأصلي في العمليات البركانية بهذه العملية.
مع النقل المتزامن لثاني أكسيد الكبريت وكبريتيد الهيدروجين من خلال المحلول القلوي ، تتشكل الثيوسلفات:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
كبريتيد الهيدروجين في الظروف العادية هو غاز عديم اللون وسامة للغاية مع رائحة مميزة من البيض الفاسد.
للحصول عليه في المختبر ، يضاف حمض الهيدروكلوريك المخفف عادةً إلى الكبريتيد:
هناك طريقة أخرى لإنتاج كبريتيد الهيدروجين وهي إضافة الماء البارد إلى كبريتيد الألومنيوم:
إن كبريتيد الهيدروجين الناتج بهذه الطريقة يكون أنظف.
كبريتيد الهيدروجين مركب تساهمي. تحتوي جزيئاتها على هيكل منحني يشبه تركيب جزيئات الماء (انظر القسم 2.2). ومع ذلك ، على عكس الماء ، لا تشكل جزيئات كبريتيد الهيدروجين روابط هيدروجينية مع بعضها البعض. والحقيقة هي أن ذرة الكبريت أقل إلكترونيا من ذرة الأكسجين ، ولكن حجمها أكبر. لذلك ، فإن ذرة الكبريت لديها كثافة شحن أقل بكثير من ذرة الأكسجين. بسبب نقص روابط الهيدروجين ، يحتوي كبريتيد الهيدروجين على درجة غليان أقل من الماء. كما أن غياب روابط الهيدروجين في كبريتيد الهيدروجين يفسر ضعف قابليته للذوبان في الماء.
في محلول مائي ، يحتوي كبريتيد الهيدروجين على خصائص حمض ديباسيك ضعيف:
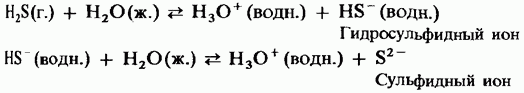
كبريتيد الهيدروجين يحترق في الهواء مع لهب أزرق. مع وصول الهواء المحدود ، يترافق حرق كبريتيد الهيدروجين مع إطلاق الكبريت الحر ، والذي يتكثف على سطح البارد للسفينة:
مع وصول الهواء الزائد ، يؤدي احتراق كبريتيد الهيدروجين إلى تكوين ثاني أكسيد الكبريت:
كبريتيد الهيدروجين له خصائص مخفضة. على سبيل المثال ، يغير لون الماء من البروم ويقلل الأيونات إلى الأيونات.
يمكن أن يشكل كبريتيد الهيدروجين كحمض ديباسيك صفين من الأملاح - كبريتيد وهيدروسولفيدات (انظر أعلاه). تذوب كبريتيدات الفلزات القلوية في الماء لتشكيل المحاليل القلوية. يحدث هذا نتيجة للتحلل المائي:
يمكن ترسيب كبريتيدات غير قابلة للذوبان من معادن أخرى من المحاليل المائية لأملاح هذه المعادن عن طريق تمرير كبريتيد الهيدروجين عبر المحلول. على سبيل المثال ، من خلال تمرير كبريتيد الهيدروجين من خلال محلول يحتوي على أيونات ، يتم تشكيل رواسب الكبريتيد السوداء
يستخدم هذا التفاعل كعينة تحليلية لكبريتيد الهيدروجين.
أكاسيد الكبريت
يتكون الكبريت من أكاسيد عديدة ، أهمها اثنين: ثاني أكسيد الكبريت وثاني أكسيد الكبريت.
ثاني أكسيد الكبريت هو غاز كثيف لا لون له رائحة كريهة وخانقة. تحت ظروف المختبر ، يمكن الحصول عليها عن طريق حرق الكبريت في الهواء أو في الأكسجين ، بإضافة محلول حامض مخفف دافئ لبعض ملح الكبريت ، أو عن طريق تسخين حامض الكبريتيك المركز مع النحاس:
ثاني أكسيد حامض ثاني أكسيد الكبريت. يذوب بسهولة في الماء ، ويشكل حمض الكبريتيك. هذا الحمض مؤين جزئياً فقط ، وبالتالي فهو حمض ضعيف:
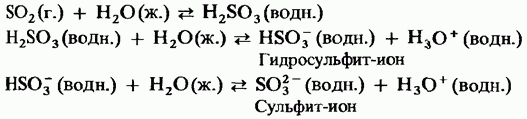
عن طريق تمرير غاز ثاني أكسيد الكبريت من خلال محلول هيدروكسيد الصوديوم ، يتم تشكيل كبريتيت الصوديوم. يشكل كبريتيت الصوديوم ، الذي يتفاعل مع وجود فائض من ثاني أكسيد الكبريت ، هيدروسلفيت الصوديوم ، وتشبه هذه التفاعلات تفاعل ثاني أكسيد الكربون مع ماء الليمون.
يعمل كل من ثاني أكسيد الكبريت الغازي ومحلوله المائي على تقليل العوامل. على سبيل المثال ، يقلل ثاني أكسيد الكبريت الغازي من الأكسيد ليشكل كبريتات ويخفض حمض الكبريتيك الأيون إلى أيون
يتم الحصول على ثاني أكسيد الكبريت في الظروف الصناعية عن طريق تحميص خامات الكبريت أو الكبريتيد في الهواء ويستخدم كمنتج وسيط في عملية الحصول على حمض الكبريتيك (انظر الفصل 7). يستخدم ثاني أكسيد الكبريت في صناعة اللب ، لتبييض الأقمشة ، وكذلك لمعالجة الفواكه والخضروات أثناء التخزين على المدى الطويل.
يلعب ثاني أكسيد الكبريت دورًا مهمًا في تلوث الغلاف الجوي وخاصة في تكوين الأمطار الحمضية. في الجو ، يتأكسد إلى ثالث أكسيد الكبريت:
في ظل الظروف العادية ، تستمر هذه العملية ببطء ، ولكن في ظل وجود محفز ، يمكن تسريعها بشكل كبير ، كما يحدث في عملية التلامس لإنتاج حامض الكبريتيك. كميات صغيرة من مركبات الحديد والمنغنيز في الجو يبدو أنها تحفز أكسدة ثاني أكسيد الكبريت. يتفاعل ثالث أكسيد الكبريت الناتج مع الرطوبة في الهواء ، وبالتالي تظهر السحب التي تحمل المطر الحمضي (انظر أيضًا الفصل 12).
ثالث أكسيد الكبريت الصلب هو مركب متعدد الأشكال. أهم شكلين له: الأول هو قاطع ذو هيكل دوري (الشكل 15.24 ، أ) ؛ بلورات شفافة. لديه هيكل البوليمر الحلقية (الشكل 15.24 ، ب) ؛ كان موجودا في شكل إبر. نقطة انصهار في وجود الرطوبة ، يتحول تدريجيا إلى كلا النموذجين يغلي عند 45 درجة مئوية. يتكون بخار ثالث أكسيد الكبريت من جزيئات مسطحة متماثلة معزولة.
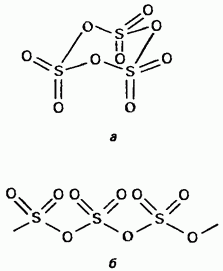
التين. 15.24. ثالث أكسيد الكبريت ، هيكل دوري ، بنية غير متجانسة.
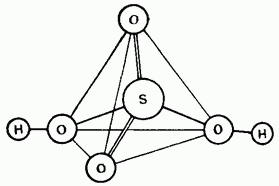
التين. 15.25. هيكل جزيء حمض الكبريتيك.
في ظروف المختبر ، يتم الحصول على ثالث أكسيد الكبريت عن طريق تسخين الكبريتات
لقد أوضح ثالث أكسيد الكبريت الخصائص الحمضية بقوة. يتفاعل طاردًا للحرارة مع الماء لتكوين حمض الكبريتيك:
ثالث أكسيد الكبريت هو عامل مؤكسد قوي. على سبيل المثال ، إنه يتأكسد بروميد الهيدروجين لتحرير البروم.
حمض الكبريتيك
حمض الكبريتيك هو سائل كوني زيتي عديم اللون. انها واحدة من أهم المنتجات الكيميائية الصناعية. ويرد وصف الإنتاج الصناعي باستخدام عملية الاتصال والتطبيق في الفصل. 7.
حمض الكبريتيك غير المخفف هو مركب تساهمي. جزيئاتها لها هيكل رباعي السطوح (الشكل 15.25).
يغلي حمض الكبريتيك ويتحلل عند درجة حرارة 340 مئوية ، ويشكل ثالث أكسيد الكبريت والماء
من الواضح أن نقطة الغليان العالية واللزوجة العالية لحمض الكبريتيك ترجعان إلى وجود روابط هيدروجينية بين ذرات الهيدروجين وذرات الأكسجين في الجزيئات المجاورة.
حمض الكبريتيك هو حمض ديباسيك قوي. في الماء ، يتم تأينه بالكامل ، مكونًا أيونات الهيدروسلفات والكبريتات:
ويشارك حمض الكبريتيك في جميع ردود الفعل المميزة للأحماض. يتفاعل مع المعادن ، وتشكيل كبريتات هذه المعادن والهيدروجين ، في ردود الفعل مع الكربونات تشكل كبريتات وثاني أكسيد الكربون والماء ، وفي التفاعلات مع القواعد والقلويات تشكل كبريتات أو هيدروسلفات.
يتفاعل حمض الكبريتيك المركز بعنف شديد مع الماء. لهذا السبب ، يجب عليك دائمًا تخفيف حمض الكبريتيك عن طريق سكبه في الماء ، وليس العكس. هذا الحمض استرطابي ، أي أنه قادر على امتصاص الرطوبة من الهواء. لذلك ، يتم استخدامه لتجفيف الغازات التي لا تتفاعل معها ، وتمريرها عبر حمض الكبريتيك. إن تقارب حمض الكبريتيك في الماء كبير لدرجة أن حمض الكبريتيك يمكن أن يكون عامل تجفيف ؛ تحت تأثير حمض الكبريتيك المركز:
بلورات زرقاء من كبريتات بنتاهيدرات تشكل كبريتات لا مائية
الكربوهيدرات ، مثل السكروز ، متفحمة:
يتم تفحم الورق أيضًا بواسطة عمل حمض الكبريتيك المركز ، بسبب عمل الحامض على ألياف السليلوز ؛
يتم تحويل الإيثانول إلى الإيثيلين:
(الجفاف الإيثانول مع حمض الكبريتيك ، نفذت في السيطرة عليها
الظروف ، يؤدي إلى تكوين إيثوكسيتيثان (إيثيل الإيثر) ، ويستخدم هذا التفاعل لإنتاج إيثوكسييثان على نطاق صناعي) ؛
يتم تجفيف مزيج من الكلورو بنزين وثلاثي كلورو إيثانال (كلورال) (انظر الفقرة 16.3).
حمض الكبريتيك المركز هو عامل مؤكسد قوي. انها أكسدة المعادن وغير المعادن. على سبيل المثال
كأمثلة أخرى توضح الخواص المؤكسدة لحمض الكبريتيك المركز ، نشير إلى أكسدة الأيونات للأيونات ، وأيونات البروميد لتحرير البروم في التفاعلات التالية:
أخيرًا ، يستخدم حمض الكبريتيك كعامل كبريت في الكيمياء العضوية (انظر الفصل 17).
الكبريتات والكبريتيت ومركبات الثيو
يحتوي أيون الكبريت على هيكل رباعي السطوح يشبه تركيب جزيء حمض الكبريتيك.
الملح. تتشكل الكبريتات في تفاعلات حمض الكبريتيك المخفف مع المعادن ، أكاسيدها ، هيدروكسيدات أو كربونات. باستثناء كبريتات الباريوم والباقي من كبريتات قابل للذوبان في الماء. كبريتات الكالسيوم لديه قابلية ذوبان منخفضة في الماء. الكبريتات عادة ما تكون مقاومة للحرارة. الاستثناءات الوحيدة هي كبريتات الحديد. على سبيل المثال ، تتحلل الكبريتات عند تسخينها لتشكيل أكسيد الحديد:
يضاف محلول مائي من كلوريد الباريوم للكشف عن أيونات الكبريتات في أي محلول. عندما تكون أيونات الكبريتات موجودة في محلول الاختبار ، تتشكل مادة راسب أبيض من كبريتات الباريوم نتيجة لذلك:
للكبريتات العديد من الاستخدامات المهمة. على سبيل المثال ، يتم استخدام كبريتات المغنيسيوم (الملح البريطاني ، الملح المر) في صناعة المتفجرات ، لتصنيع المباريات والأقمشة المقاومة للحريق. يستخدم محلول مشبع من هذا الملح في الممارسة الطبية كعامل مضاد للالتهابات.
يمكن اعتبار ثيوسلفات الصوديوم تماثلًا لكبريتات الصوديوم ، حيث يتم استبدال ذرة أكسجين واحدة بذرة كبريت. من بين هذه المركبات thioso ، ينبغي ذكر عنصر آخر - ثيوسيانات البوتاسيوم. وهو التناظرية الكبريت من سيان البوتاسيوم. يمكن الحصول على ثيوسيانات البوتاسيوم عن طريق دمج سيانيد البوتاسيوم بالكبريت:
يستخدم ثيوسيانات البوتاسيوم في التحليل النوعي للكشف عن الأيونات ، وإذا كانت هذه الأيونات موجودة في محلول الاختبار ، فإن إضافة محلول ثيوسيانات البوتاسيوم يؤدي إلى لون أحمر الدم بسبب تكوين أيون معقد
كرر ذلك مرة أخرى!
1. عند الانتقال إلى الجزء السفلي من المجموعة VI ، تتغير خصائص عناصرها تدريجياً من غير معدني إلى معدني.
2. عناصر المجموعة السادسة لها القدرة على الاندماج مع الهيدروجين والمعادن التفاعلية ، والتي تشكل مركبات لها حالة أكسدة -2.
3. الأكسجين لديه كهرومائية عالية وخصائص عامل مؤكسد قوي.
4. الأوزون هو مؤكسد أقوى من الأكسجين.
5. يلعب الأكسجين دورًا مهمًا للغاية في النظم البيولوجية ، حيث يشارك في عمليات التنفس والتمثيل الغذائي (التمثيل الغذائي).
6. الأكسجين يشكل مركبات ثنائية ، أكاسيد من أنواع مختلفة مع مركبات أخرى:

7. بيروكسيد الهيدروجين عامل مؤكسد قوي.
8. الكبريت في شكل حر يمكن أن توجد في العديد من الأشكال enaniotropic.
9. لاستخراج الكبريت من رواسب تحت الأرض ، يتم استخدام عملية Frash ، والتي تستخدم الهواء المضغوط والبخار المحمص.
10- تشكل الكبريت مركبات تكون فيها حالات أكسدة +2 و +4 و +6 و -2.
11. كبريتيد الهيدروجين - حامض ديباسيك ضعيف وعامل اختزال.
12. ثاني أكسيد الكبريت الغازي وعوامل تقليل محلول مائي.
13- لقد أوضح ثالث أكسيد الكبريت خصائص الحمض والمؤكسد بقوة.
14. حمض الكبريتيك هو حمض dibasic قوي ، المجففة ، وكيل التجفيف وعامل مؤكسد قوي.
15. جزيئات حمض الكبريتيك وأيونات الكبريت لها هيكل رباعي السطوح.