Pri spajanju 28 g silikona sa kiseonikom. Silikonski spojevi kiseonika
Glavna razlika u odnosu na ugljik: odsustvo p spojeva u spojevima Silicidi, spojevi s vodikom (silani), oksidacija i hidroliza, tetrafluorid i silicij tetraklorid, hidroliza, heksafluorosilikati, spojevi kisika, silicij oksid (IV). Silikati, rastvorljivost i hidroliza, prirodni silikati i aluminosilikati, zeoliti, organosilikonski spojevi, silikoni i siloksani, upotreba silicijumskih jedinjenja u medicini.
Silicon (lat. Silicij), Si, hemijski element IV grupe Periodnog sistema; atomski broj 14, atomska masa 28.086. Silicon takođe pokazuje sp3 hibridizaciju elektronskih
orbitale. Na vanjskom elektronom sloju silicijevog atoma postoji valenca 3d-
orbitale (Si: 3s23p23d0),
Silicijum nakon što je kiseonik najčešći element u kori. Za razliku od ugljenika u slobodnom stanju, silicij se ne nalazi u prirodi. Najčešća jedinjenja su silicijum oksid (IV) SiO2 i silikatne kiseline, silikati. Oni formiraju ljusku zemljine kore. Silikonski spojevi se nalaze u biljkama i životinjama. Po hemijskim svojstvima, silicij, kao i ugljenik, je nemetal, ali je njegova nemetalnost manje izražena, jer ima veći atomski radijus
Silicon. formira spojeve sa skoro svim metalima - sa icicides (nisu pronađena jedinjenja samo sa Bi, Tl, Pb, Hg). Dobijeno je više od 250 silicida, čiji sastav (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si, itd.) Obično ne odgovara klasičnim valencijama. Silikidi se razlikuju po vatrostalnosti i tvrdoći; Najveći praktični značaj imaju ferosilicij (redukcijski agens u topljenju specijalnih legura, vidi ferolegure) i molibdenov silicid MoSi2 (grijači električnih peći, lopatice plinskih turbina itd.).
Silane Pod dejstvom hlorovodonične kiseline na silicide, najjednostavnije vodonično jedinjenje silicija je silan SiH4:
Silan je otrovni gas sa neprijatnim mirisom koji se spontano pali. vazduh
Oni su reaktivni i jaki redukcioni agensi.
reaguju sa vodom na sobnoj temperaturi:
SiH4 + 2H2O → SiO2 + 4H2,:
Tetrafluorid Silicijum se proizvodi fluoriranjem silicijum dioksida elementarnim fluorom.
Proces fluoriranja se provodi u dvije faze u plamenom reaktoru, usmjeravajući višak elementarnog fluora iz prve faze u 2. stupanj.
Tehnički rezultat je proizvodnja silikona u kontinuiranom režimu sa visokim prinosom i kvalitetom proizvoda.
Silicijum tetrafluorid SiF4 nastaje djelovanjem fluorovodične (fluorovodične) kiseline na staklo:
Na2SiO3 + 6HF ® 2NaF + SiF4 + 3H2O
Silikonski spojevi kiseonika
Najvažniji kisikov spoj silicija je silicijum dioksid SiO2 (silika), koji ima nekoliko kristalnih modifikacija.
Niskotemperaturna modifikacija (do 1143 K) naziva se kvarc. Kvarc ima piezoelektrična svojstva. Prirodne sorte kvarca: kameni kristal, topaz, ametist. Sorte silicijum dioksida su kalcedon, opal, agat. jaspis, pijesak.
Silica je hemijski otporna; na njega utiču samo fluorna, fluorovodična i alkalna otopina. Lako se pretvara u staklasto stanje (kvarcno staklo). Kvarcno staklo je krhko, vrlo kemijski i termički otporno. Odgovarajuća silicijumska kiselina SiO2 nema specifičan sastav. Tipično, silicijumska kiselina se evidentira kao xH2O-ySiO2. Odabrane su silicijumske kiseline: H2SiO3 (H2O-SiO2) - meta-silicij (tri-okso-silikon), H4Si04 (2H20-Si02) - orto-silicij (tetra-okso-silikon), H2Si2O5 (H2O * SiO2) - dimetički silicij.
Silikatne kiseline su slabo rastvorljive supstance. U skladu sa manje metaloidne prirode silicija u odnosu na ugljenik, H2SiO3 kao elektrolit je slabiji od H2CO3.
Odgovarajućim silicijumskim kiselinama soli-silikati u vodi su nerastvorljivi (osim silikata alkalnih metala). Rastvorljivi silikati hidroliziraju se jednadžbom
2SiO3 - + H20 = Si2O52- + 20H-.
Koncentrirane otopine topljivih silikata se nazivaju tekuće staklo. Uobičajeni prozorski stakleni silikat natrija i kalcija ima sastav Na20-CaO-6Si02. Dobija se reakcijom
Poznat je veliki broj silikata (točnije oksosilikata). U strukturi oksosilikata se uočava određena pravilnost: sve se sastoje od tetraedera Si04, koje su međusobno povezane preko atoma kiseonika. Najčešće kombinacije tetraedara su (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), koje se, kao strukturne jedinice, mogu kombinovati u lance, trake, mreže i kosture (slika 4).
Najvažniji prirodni silikati su, na primjer, talk (3MgO * H20-4Si02) i azbest (SmgO * H2O * SiO2). Kao i kod SiO2, staklasto (amorfno) stanje je karakteristično za silikate. Sa kontrolisanom kristalizacijom stakla moguće je dobiti fino-kristalno stanje (sitals). Sita se odlikuju povećanom snagom.
Osim silikata, aluminosilikati su široko rasprostranjeni u prirodi. Aluminosilikati - okvir oksosilikata, u kojima je dio atoma silicija zamijenjen trovalentnim Al; npr. Na12 [(Si, Al) 04] 12.
Za silicijumsku kiselinu karakteristično je koloidno stanje kada soli kiseline H2SiO3 nisu odmah pogođene. Koloidne otopine silicijeve kiseline (solovi) pod određenim uvjetima (npr. Kada se zagrijavaju) mogu se pretvoriti u prozirni, homogeni gel-nalik maseni gel silicijumske kiseline. Geli su visokomolekularni spojevi sa prostornom, vrlo labavom strukturom koju formiraju molekuli SiO2, čije su praznine ispunjene molekulima H2O. Kada se dehidrira silika gel, dobija se silika gel - porozni proizvod sa visokim kapacitetom adsorpcije.
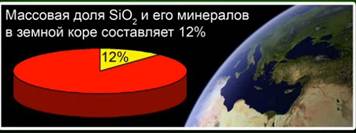
Silicijum oksid (IV) (silika) - najčešći sastojak u zemljinoj kori, koji čini 12% njegove mase u obliku raznih minerala. Razlikujte kristalni i amorfni silicijum dioksid. Najjednostavnija formula za silicijum oksid (IV) je SiO2. Kristalizira se u atomskoj rešetki.
1) Kristalni silicijum - u obliku minerala kvarca i njegovih sorti (kameni kristal, kalcedon, ahat, jaspis, kremen); Kvarc je osnova kvarcnog peska koji se široko koristi u građevinarstvu iu industriji silikata.
2) Amorfni silicijum - u obliku opalnog mineralnog sastava SiO2 nH2O; zemljani oblici amorfnog silicijuma su diatomit, Tripoli (infuzorijska zemlja); Primjer umjetnog amorfnog bezvodnog silicijevog dioksida je silikagel, koji se dobiva iz natrijevog metasilikata:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Silikagel ima razvijenu površinu i zato dobro upija vlagu.
Silica gel je osušeni gel formiran od prezasićenih rastvora silicijeve kiseline (nSiO2 · mH2O) pri pH\u003e 5-6. Čvrsti hidrofilni sorbent.
Getting
Dobiva se zakiseljavanjem silikatnih rastvora alkalnih metala, nakon čega slijedi pranje i sušenje formiranog gela:
Silicic acid. SiO2 je anhidrid određenog broja silicijumskih kiselina
Silikatna kiselina je izgrađena od tetraedrijskih strukturnih jedinica (u svakoj takvoj jedinici atom silicija je u centru tetraedra, a atomi kiseonika se nalaze na vrhovima). Strukturne veze, koje se spajaju u lancima, formiraju stabilnije polisilicijske kiseline:
Sastav takvog jedinjenja može se izraziti formulom (H2SiO3) n. Međutim, silicijumska kiselina je obično predstavljena formulom H2SiO3. H2SiO3 - kiselina je vrlo slaba, slabo topljiva u vodi. Kada se zagreva, lako se raspada na isti način kao i ugljična kiselina:
Sve silicijske kiseline su veoma slabe (slabije od uglja).
Silikati. Soli svih silicijumskih kiselina nazivaju se silikati, mada silikati u pravilu podrazumijevaju soli metakristalne kiseline. Njihov sastav je obično predstavljen formulom u obliku jedinjenja oksida elemenata. Na primjer, kalcijev silikat CaSiO3 može se izraziti kao: CaO × SiO2.
Silikati sastava R2O × nSiO2, gde je R2O natrijum ili kalijum oksid, nazivaju se rastvornim staklom, a njihovi koncentrirani vodeni rastvori se nazivaju tečno staklo. Najvažnije je natrijum rastvorljivo staklo.
Kada stoje na vazduhu, rastvori silikata postaju mutni, jer ugljen dioksid (IV) u vazduhu zamenjuje silicijumsku kiselinu iz njenih soli:
Silikatna kiselina je praktično nerastvorljiva u vodi - ovo svojstvo se koristi kao kvalitativna reakcija na ion SiO32-.
Silikati se dobijaju fuzijom silicijum dioksida sa alkalijama ili karbonatima:
Rastvorljivost silikatne kiseline i brzina njegovog rastvaranja zavisi od nekoliko faktora, od kojih su najvažniji modifikacija preuzetog silicijum dioksida, njegov stepen disperzije i temperatura. Prilikom protresanja silika gela sa vodom, ravnoteža topljivosti se uspostavlja za nekoliko sati, u slučaju kvarca su potrebni mnogi mjeseci i čak godine.
PRIRODNI SILIKATI (od latinskog. silex, rod. slučaj silicis - kremen * a. prirodni silikati; N. naturliche Silikate; F. silikati naturels; i. silicatos naturales) - klasa minerala, soli silicijevih, izo- i heteropolikarminskih kiselina. Udio prirodnih silikata čini do 75% mase zemljine kore i oko 25% mineralnih vrsta. U prirodi je poznato više od 700 prirodnih silikata, uključujući i najznačajnije minerale koji formiraju stijene (feldspati, pirokseni, amfiboli, stjenke itd.)
Aluminosilikati - grupa prirodnih i sintetičkih silikata, čiji kompleksni anioni sadrže silicijum i aluminijum. Primjeri kompleksnih aniona: -, -, 2 -. Na +, K +, Mg2 +, Ca2 +, a ponekad i Ba2 + i Li + djeluju kao kationi.
Prirodni aluminosilikati su najčešći minerali, koji čine do 50% mase zemljine kore. To su feldspati (albit, ortoklas, anortit), minerali gline i tinjac.
Zeoliti - To su vodeni aluminosilikati kalcijuma, natrija, kalija, barija i nekih drugih elemenata. Grupa zeolita uključuje više od četrdeset minerala, koji se razlikuju po sastavu (posebno po broju molekula vode u kristalnom hidratu), i naravno u fizičkim i hemijskim svojstvima. Međutim, gotovo svi predstavnici ove grupe minerala imaju zajedničku osobinu - oni su dobri sorbenti, posjeduju ionsko-izmjenjivačka svojstva, sposobni su mijenjati pokretljivost pojedinih iona i raditi kao molekularna sita. I relativno nedavno, ovi minerali su pronašli potpuno neočekivanu upotrebu - počeli su da se koriste u poljoprivredi.
Organosilikonski spojevi - spojevi u čijim molekulama postoji veza između atoma silicija i ugljika. Organosilicijumska jedinjenja se ponekad nazivaju silikoni, od latinskog silicijumskog naziva "silicij". Organosilicijumska jedinjenja se koriste za proizvodnju maziva, polimera, guma, guma, silikonskih tečnosti i emulzija. Organosilicijumska jedinjenja se koriste u kozmetici, kućnoj hemiji, bojama i lakovima, deterdžentima. Karakteristična karakteristika proizvoda na bazi organosilikonskih jedinjenja iz proizvoda na bazi uobičajenih organskih jedinjenja su, po pravilu, bolje karakteristike i karakteristike performansi, kao i bezbednost ljudske upotrebe. Silikonski polimeri se mogu koristiti za izradu kalupa u kuhanju. Polimerizacija organosilikonskih jedinjenja i zaptivača je bezbedna za ljude i ne zahteva ekstrakciju.
Siloksani - jedinjenja koja sadrže naizmenične silicijeve i kiseonične atome u molekulu. Najviše imaju siloksane visoke molekulske mase - poliorganosiloksane; vidi Silikonski polimeri.
Silikoni (poliorganosiloksani) - oksigenisana organosilicijumska jedinjenja visoke molekulske mase sa hemijskom formulom n, gde je R = organska grupa (metil, etil ili fenil). Sada se ova definicija izuzetno retko pridržava, a poliorganosiloksani (na primer, silikonska ulja tipa PMS, repelenti za vodu tipa NGL ili SKTN gume niske molekularne mase), pa čak i organosilikonski monomeri (različiti silani) se takođe kombinuju u "silikone", brišući razliku između "silikona" i " silikon. "
Metalni silicij  Crystal Silicon
Crystal Silicon
Silicon (Si). Ovaj hemijski element je 1/4 sastava zemljine kore. Kvarc, kameni kristal, pesak, glina, granit, tinjac, azbest - sve ovo hemijskih jedinjenja silicija
Silicij je srednji element (amfoterni) i može pokazivati i metalna i nemetalna svojstva. Može da formira hemijska jedinjenja, i sa metalima i sa nemetalima.
Čisti silicij - hemijski jednostavna supstanca sive boje, tvrda, vatrostalna i lomljiva. Crystal Silicon Ima metalik sjaj i široko se koristi u poluprovodničkoj industriji (to je poluprovodnik).
Silikon se može rastezati kao u kristalnom stanju ( kristalni silicij), iu amorfnom stanju ( amorfni silicij). Kristalni silicij nastaje hlađenjem otopine amorfnog silicija u rastopljenom metalu. S druge strane, kristalni silicij je vrlo lomljiv materijal i lako se razbija u amorfni prah. Dakle, amorfni silicij je fragment kristala kristalnog silicija.
U slobodnom stanju, silicij je vrlo teško dobiti. Njegova industrijska proizvodnja povezana je s oporavkom kvarca, čija je kemijska formula SiO 2, reakcija redukcije se proizvodi vrućim koksom (ugljik).
SiO 2 + C → CO 2 + Si
U laboratoriji, čisti silicij se redukuje iz kvarcnog peska sa metalnim magnezijumom koristeći sledeću reakciju:
SiO 2 + 2Mg → Si + 2MgO.
Tokom ove reakcije formira se smeđi prah amorfnog silicija. Prilikom zagrijavanja, prah može polako reagirati s koncentriranim otopinama alkalija (na primjer, natrijev hidroksid NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - rezultirajuća kompleksna supstanca - koja se naziva i tekuće staklo.
Zanimljivo je da hemijska aktivnost silicija zavisi od veličine njegovih kristala. Ko-kristalni silicij je manje hemijski aktivan od amorfnog. Potonji reaguje lako sa fluorom čak i na običnoj temperaturi, a na temperaturi od 400 - 600 ° C reaguje sa kiseonikom, hlorom, bromom, sumporom i formira odgovarajuće hemijske spojeve. Na veoma visokim temperaturama, silicij reaguje sa azotom i ugljenikom kako bi formirao, odnosno, nitrid i silicijum karbid.
Ako pokušate rastvoriti silicijum u smjesi fluorovodične HF (fluorovodične) i dušične HNO 3 kiseline, reakcija se neće nastaviti. Ali, ako vodite hemijsku reakciju sa alkalijom, na primer, sa kalijum hidroksidom, reakcija će se odvijati sa formiranjem soli silicijumske kiseline.
Si + KOH → K 2 SiO 3 + H 2
Ako se kalcinuje u peći silicijum (pijesak) sa koksom, ispada veoma čvrsta kristalna supstanca. Carborundum SiC
SiO 2 + 3C → SiC + 2CO
Carborundum - vrlo tvrda i vatrostalna supstanca. U industriji se zbog ovih svojstava proizvodi u velikim količinama. Zanimljivo je da je karborundska kristalna rešetka slična rešetki najteže supstance - dijamant, ali u njoj su pojedinačni atomi ugljenika jednako zamenjeni atomima silicija.
Na visokim temperaturama, kao i tokom hemijskih reakcija pod dejstvom kiselina na spojeve metala sa silicijumom, silane SiH 4.
Silane - to je samozapaljivi bezbojni plin. Može se zapaliti u zraku i formirati silicijum dioksid i vodu.
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
Ako se silicijum oksid SiO 2 zagreva u prisustvu ugljenika u struji hlora, dolazi do hemijske reakcije sa formiranjem silicijum hlorida.
SiO 2 + 2C + 2 Cl 2 → SiCl 4 + 2CO
Silicijum hlorid - to je tekućina čija je temperatura vrenja samo 54 ° C. Silicijev klorid se lako otapa u vodi s nastankom otopine dvije kiseline: silikatne i solne
SiCl 4 + H 2 O → H 2 SiO 3 + HCl
Ako se ova hemijska reakcija odvija u atmosferi vlažnog zraka, pojavljuje se gusti dim tijekom stvaranja dvije kiseline.
Silicijum fluorid SiF 4 - nastao kao rezultat kemijske reakcije fluorovodične kiseline i silicijevog oksida
SiO 2 + 4HF → SiF 4 + 2H 2 O
Silicijum fluorid je bezbojni gas sa "jakim" mirisom. Kao i silicijum-klorid, u vodi ovaj plin formira dvije kiseline: silicijum i fluoro fluor. Ali interesantno je da silicijum fluorid može da stupi u interakciju sa fluorovodičnom kiselinom hexafluorosilicic acid čija je hemijska formula H 2 SiF 6. Njegove soli i sama kiselina su otrovne.
Silicon
Osnovni metali i nemetali
U ovoj lekciji ćete proučavati temu "Silicijum". Razmotrite informacije o silicijumu: njegova elektronska struktura, gde je silicijum u prirodi, proučava silikonsku alotropiju, objašnjava njene fizičke i hemijske osobine. Saznajte gdje se silicij koristi u industriji i drugim područjima, kako se proizvodi. Upoznaćete silicijum, silicijumsku kiselinu i njene soli - silikate.
Tema: Osnovni metali i nemetali
Lekcija: Silicijum. Plemeniti gasovi
Silicij je jedan od najčešćih hemijskih elemenata u zemljinoj kori. Sadržaj je skoro 30%. U prirodi se uglavnom nalazi u obliku različitih oblika silicijum dioksida, silikata i aluminosilikata.
Silikon je tetravalentan u gotovo svim svojim jedinjenjima. U ovom slučaju, atomi silicija su u uzbuđenom stanju. Sl. 1.
Za ulazak u ovo stanje, jedan od 3s elektrona zauzima prazno mjesto na 3p orbitali. U ovom slučaju, umesto dva nesparena elektrona u osnovnom stanju, atom silicija u pobuđenom stanju će imati 4 neparena elektrona. On će moći da formira 4 kovalentne veze putem mehanizma razmene.


Atomi silicija nisu skloni formiranju višestrukih veza, već formiraju jedinjenja sa jednostrukim vezama - Si-O-. Silicijum, za razliku od ugljenika, nije tipičan za alotropiju.
Jedan od alotropna modifikacija je kristalni siliciju kojoj je svaki atom silicija u sp3 hibridizaciji. Sl. 2, 3. Kristalni silicij je čvrsta, vatrostalna i trajna kristalna supstanca tamnosive boje sa metalnim sjajem. Pod normalnim uvjetima - poluvodič. Ponekad se amorfni silicij emituje kao još jedna alotropna modifikacija silikona. To je tamno braon prah, hemijski aktivniji od kristalnog silicijuma. Da li je to alotropna modifikacija je sporna tačka.
Kemijska svojstva silicija
1. Interakcija sa halogenima
Si + 2F 2 → SiF 4
2. Kada se zagreva, silicij gori u kiseoniku, formira se silicijum (IV).
Si + O 2 → SiO 2
3. Na visokim temperaturama, silicij interagira sa azotom ili ugljikom.
3Si + 2N 2 → Si 3 N 4
4. Silicij ne reaguje sa vodenim rastvorima kiselina. Ali rastvara se u alkalijama.
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2
5. Kada se silikon spoji sa metalima, formiraju se silicidi.
Si + 2Mg → Mg 2 Si
6. Silicij nije direktno u interakciji sa vodonikom, ali vodonični spojevi silikona mogu se dobiti interakcijom silicida sa vodom.
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (silan)
Silani su po strukturi slični alkanima, ali su znatno reaktivni. Najstabilniji monosilan je zapaljiv u vazduhu.
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
Getting silicon
Silicij se dobija redukcijom iz silicijum oksida (IV)
SiO 2 + 2Mg → Si + 2MgO
Jedan od zadataka je dobijanje silicijuma visoke čistoće. U tu svrhu, tehnički silicij se prenosi na tetraklorid silicija. Dobijeni tetraklorid se redukuje na silan, a silan se razgrađuje u silicij i vodonik kada se zagreva.
Silikon može da formira dva oksida: SiO2 - silicijum oksid (IV) i SiO - silicijum oksid (II).
SiO - silicijum oksid (II) - to je amorfna tamno braon supstanca koja nastaje interakcijom silicija sa silicijum oksidom (IV)
Si + Sio 2 → 2 Sio.
Uprkos svojoj stabilnosti, ova supstanca se gotovo nikada ne koristi.
SiO 2 - silicijum oksid (IV)


Ova supstanca predstavlja 12% zemljine kore. Sl. 4. Predstavljen je takvim mineralima kao što su kameni kristali, kvarc, ametist, citrin, jaspis, kalcedon. Sl. 5
SiO2 - silicijum oksid (IV) - supstanca nemolekularne strukture.
Njegova kristalna rešetka je atomska. Sl. 6. Kristali SiO 2 imaju oblik tetraedra koji su međusobno povezani atomima kiseonika. Forma molekula (SiO2) n bi bila ispravnija. Budući da SiO 2 tvori supstancu atomske strukture, a CO 2 - molekularne strukture, razlika u njihovim svojstvima je očigledna. CO 2 je plin, a SiO2 je čvrsta prozirna kristalna supstanca, nerastvorljiva u vodi i vatrostalna.
Hemijska svojstvaSiOko 2
1. Silikon oksid (IV) SiO2 je kiseli oksid. Ne reagira s vodom. Silikatna kiselina se ne može dobiti hidratacijom SiO 2. Njegove soli, silikati, mogu se dobiti reakcijom SiO 2 s vrućim alkalnim otopinama.
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2. Reaguje sa karbonatima alkalnih i zemnoalkalnih metala.
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. Interakcija sa metalima.
SiO 2 + 2Mg → Si + 2MgO
4. Reakcija sa fluorovodičnom kiselinom.
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
Kemijska svojstva silicijeve kiseline i silikata
Dobija se silicijumska kiselina
Silicijska kiselina se taloži kao polimerno jedinjenje. Formule silicijske kiseline -
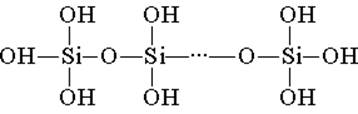
H 2 SiO 3 (meta oblik) i H 4 SiO 4 (orto oblik) - odražavaju odnos elemenata, ali ne i pravi sastav. Konvencionalno, na ravnini, sastav silicijumske kiseline je prikazan kao sl. 7
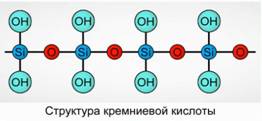
Za silicijumsku kiselinu se uvijek koristi formula H 2 SiO 3.
1. H 2 Sio 3 raspada se pri zagrijavanju
H 2 SiO 3 H 2 O + SiO 2 (silikagel)
2. Interakcija sa alkalnim rastvorima
H 2 SiO 3 + 2NaOH Na 2 SiO 3 + 2H 2 O
Soli silicijske kiseline - silikati - odnosi se na jonska jedinjenja. To su čvrste bezbojne supstance. Samo silikati alkalnih metala, osim litijuma, rastvaraju se u vodi.
1. Rastvorljivi silikati hidroliziraju anioni
Na 2 SiO 3 + H 2 O HS NaHSio 3 + NaOH
2. Rastvorljivi silikati stupaju u interakciju sa jakim kiselinama.
Na 2 SiO 3 + 2HCl → H 2 SiO 3 + 2NaCl
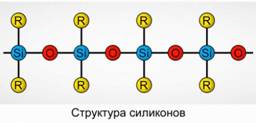
Poliorganosiloksani (silikoni)
Poliorganosiloksani (silikoni) su oksigenisana, organska silicijska jedinjenja velike molekulske mase.
R 2 [ Sio] n
R je organska grupa (metil, etil ili fenil). Osnova strukture siloksana je lanac naizmjeničnih atoma silicija i kiseonika. Sl.8. Variranjem dužine lanca i organskih grupa mogu se dobiti silikoni sa različitim svojstvima. Promjenom uvjeta polimerizacije možete dobiti molekule različitih duljina.


Polimeri kratkog lanca su tečnosti, duži su vrijedna maziva. Sl. 9, koji zadržavaju svoja svojstva u velikom temperaturnom rasponu od
100 0 S do + 300 0 S. Duži molekuli formiraju gumice koje ne gube svoju elastičnost na niskim temperaturama. Imaju visoku otpornost na trenje, hemijski su inertni. Sl. 10. To uzrokuje različite varijante njihove primjene. Mogu se koristiti za izradu veštačkih mašina za srce ili bubrege, a mogu se koristiti i kao obuća za cipele. Polimeri siloksana se koriste u medicini za stvaranje raznih implantata mekog tkiva, jer su takvi polimeri hemijski inertni i nisu odbačeni od strane organizma. Oni nisu navlaženi vodom. Koristi se u kremama. Kada nanosi ovu kremu na ruke, zameniće gumene rukavice.
Neorganski vrt
U prozirnoj čaši napunjenoj natrijum silikatom umočite kristale obojenih soli, kao što je bakar sulfat. Nakon nekog vremena, može se vidjeti da su tanke šuplje cijevi formirane od kristala, koji se sastoje od netopljivih silikata. Sl. 11

Dobijamo "glupi" kit
Jednake količine natrijum-silikata i medicinskog alkohola su pomešane. Precipitat se filtrira i istisne kako se ne bi kapalo alkohol. Ovo je kit. Sl. 12. Imenovan je tako jer je planirano da se koristi kao kita za prozore. Međutim, ispostavilo se da ima takva svojstva da se ne može koristiti po svojoj svrsi. Ako bacite loptu i bacite je na pod, ona će se odbiti kao gumena lopta. Ako se stavi na sto, proširit će se kao tekućina. Ako pogodite čvrsti predmet, on će se slomiti kao čvrsto tijelo. Nakon nekog vremena, kada se alkohol osuši, ovaj kit će se samo raspasti.
![]()
Sumiranje lekcije
U ovoj lekciji proučavali ste temu "Silicijum". Ispitali smo informacije o silicijumu: njegova elektronska struktura, u kojoj se silicij nalazi u prirodi, proučavao je alotropiju silikona, objasnio njegove fizičke i hemijske osobine. Saznali su o tome gdje se silicij koristi u industriji i drugim područjima, kako se proizvodi. Upoznali ste se sa silicijevim dioksidom, silicijumskom kiselinom i njenim solima - silikatima.
Reference
1. Rudzitis G.E. Chemistry. Osnove opće kemije. 11. razred: udžbenik za obrazovne ustanove: osnovni nivo / G.E. Rudzitis, F.G. Feldman. - 14. izd. - M: Prosvetljenje, 2012.
2. Popel P.P. Hemija: 8 cl Udžbenik za srednje škole / PP. Popel, L.S. - K .: IC "Academy", 2008. - 240 s .: Ill.
3. Gabrielyan O.S. Chemistry. 11. razred. Osnovni nivo. 2nd ed., Sr. - M .: Drofa, 2007. - 220 str.
Domaći
1. №№2-4 (str. 138) Rudzitis G.E. Chemistry. Osnove opće kemije. 11. razred: udžbenik za obrazovne ustanove: osnovni nivo / G.E. Rudzitis, F.G. Feldman. - 14. izd. - M: Prosvetljenje, 2012.
2. Koje su primjene poliorganosiloksana.
3. Uporediti svojstva alotropnih modifikacija silicija.
