Ekvivalentne reakcije, koje karakteriziraju snagu razrijeđene hlorovodonične kiseline. Spisak pregleda za ishranu iz discipline
Počorninja površina starih slika, oslikanih olyny farbsom, do skladišta, koje uključuje olovni bilil (PbCO3), povezana je sa iskazima željeznog olovnog sulfida (II) kroz pojavu vode u atmosferi. Ako površinu zalijete vodenim peroksidom, tada se uspostavlja reakcija sa olovnim (II) sulfatom bijele boje:
PbS + 4H2 O2 = PbSO4 + 4H2 O.
Na taj način restaurirati stare stare slike, oslikane starim farbama.
Zasosuvannya kisnyu i sirki
Područje skladištenja hrane predstavlja malo 61.
dozvoliti vikoristovuvati yogo za infekciju piti vodu da strane industrijske otpadne vode; kao dezinfekciono sredstvo u medicini. Ozon će pobijediti kao rezultat efuzije.
Pletenica za proizvodnju sirčanske kiseline, pripremu sirnika, bengalskih vina, borba sa školarcima države Silskoy i za pomoć djeci sa bolestima. Syrka znati skladištenje guma, barvnika i pigmenata, komadnih vlakana, luminofora i in.
Mala. 61. Zasosuvannya kisnyu

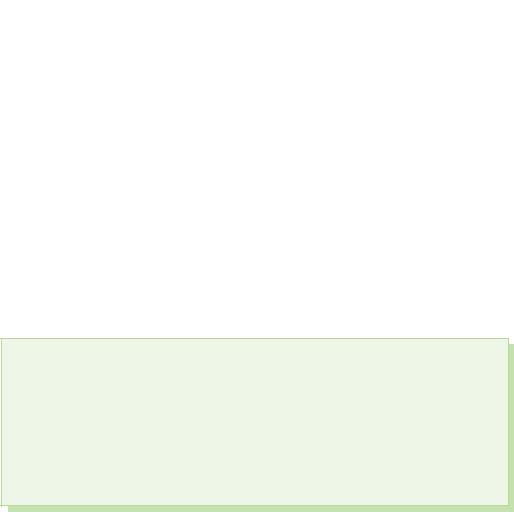
Za kiselost u spoluksu najkarakterističniji su oksidacioni koraci –2, atomi sumpora, selena i teluru su oksidirani koraci –2, +2, +4 i +6.
Oksidacija snage i kiselosti očituje se u njihovim reakcijama s metalima, vodom i djelovanjem sa nemetalima.
Napajanje i napajanje
1. Za pohranjivanje formula spoluk kisnyu s kalíêm, kaltsíêm i alumíníêm. Predstavite korake oksidiranog elementa kože i nazovite to kao dan.
2. Zaštitite glavninu sirke od aluminijum sulfida.
3. Ime "ljubac" - oksigenijum znači "scho roozhuê kiselina". Zapiši hemijske formule vídomih vam kiseline, u skladište koje će položiti element. Imenujte kiseline.
4. Znate li koje alotropne modifikacije poznajete? Koji mirisi dolaze od jedne vrste jedne stvari?
5. Za udisanje kissen z'ênutsya s krvlju hemoglobina. Naizgled, masa hemoglobina od 1 g data je zapreminom (n.u.) 1,35 cm 3. Umjesto hemoglobina u krvi zdravih ljudi 140 g/dm3. Zagalni volumen krvi - 6 dm3. Zaštitite sirastu kiselinu, jer možete završiti u krvi ljudi.
6. Visnaznit maseni udio hidrohidratne kiseline u opsegu, odsječen pri ispuštanju vode u zapremini (n.u.) 8,96 dm 3 u vodi sa masoyu 500 g.
7. Razstavte performanse u ofanzivnim šemama oksidno-bazne reakcije:
a) H2 S + Cl2 + H2 O → H2 SO4 + HCl; b) H2 S + Br2 → S + HBr;
c) H2 S + O2 → S + H2 O.
Have kožne reakcije da oksidiraju i prevladavaju.
§ 39. Kisnevmísní spoluki sírki
Have s'êdnannyakh s sirka viyavlyaê faza oksidacije+4 i +6.
Serca (IV) oksid. Čista kiselina
Sivi oksid (IV) - SO2 (čist plin) - je plin bez šipka sa oštrim karakterističnim mirisom, koji se javlja tokom tople vode:
S + O2 = t SO2.

Neki od onih koji su pronašli zastoj sirka bili su vezani dimljenim sirkom vene koja je mogla izgorjeti. Jak pisanje antičkog istoričara Plinija starijeg iz 1. veka do zvuka. Odnosno, "mirisi zapaljene vatre mogu zaštititi od svih vrsta čari i otjerati svu nečistu snagu." Dezinfekciona i baktericidna moć serumskog (IV) oksida da postane opasan odjednom. Bijeli plin stagnira pri preradi povrća, voća i voća kako bi se spriječilo truljenje.
Ispuštanje čistog gasa u blizini vode (do 40 zapremina SO2 po 1 zapremini vode) - nestiyka, dvostruka baza sircle acid yaka isnu tilki in roschini:
SO2 + H2 O H2 SO3.
Čista kiselina je slaba kiselina, u razlikama u vodi često se odvaja od iskaza hidrosulfitnih i sulfitnih jona:
H + + HSO -, | - H + + SO 2–. |
||||
Čista kiselina je hemijska moć, zagalna za kiseline: interakcija s bazičnim oksidima, bazama, ulazak u reakcijsku razmjenu sa solima nižih kiselina, kremom, vitisnya iz soli, slabom kiselinom:
Na2CO3 + H2SO3 = Na2SO3 + H2O + CO2.
Serki oksid (VI)
Serca (VI) oksid je prisutan, oksidirajući serum (IV) oksid u prisustvu katalizatora na temperaturama blizu 500 C:
t, kat.
2SO + O −−−−− ← 2SO.
2 2 ←−−−−−3
Za ekstravagantne umove, serki oksid (VI) SO3 je jalov izvor vode, koji se na temperaturama ispod 17°C pretvara u kristalnu riječ. Tse tipični kiseli oksid, koji je u sprezi s vodom jaka kisela kiselina:
SO3 + H2 O = H2 SO4.
Sirchana acid
Grafička formula i model molekula sumporne kiseline usmjereni su na malo 62.
Mala. 62. Grafička formula i model molekula kisele kiseline
Have pitanja uzgoja sirchan acid je jak elektrolit,
і njen disosíatsíyu rotirati ovako:
H2 SO4 → 2N + + SO4 2–.
Fizička snaga hlorovodonične kiseline
Važna je sirčanska kiselina (jačina 1,83 g/cm3), bez mirisa, ulja i mirisa. Vaughn će otići do vode u nekim pogledima.
Nadzira se proces određivanja H2SO4 sa hemijskom količinom od 1 mol da se vidi 92 kJ toplote, koja se može prilagoditi vrednostima toplotnih efekata u hemijskim reakcijama. Vizija velike količine toplote tokom interakcije sirhanoične kiseline i vode svedoči o stvaranju mikrosfera sa dve reči hidrata tipa H2SO4 n H2O.
Na primjer, H2 SO4 H2 O; H2 SO4 2H2 O; H2 SO4 3H2 O itd.
nova kiselina i hidrat vam omogućavaju da pokupite jako sredstvo koje nosi vodu, na primjer, za sušenje plinova.
Razvoj sume u slučaju rastvora hlorovodonične kiseline u vodi može se zameniti oslobađanjem. Zapamti, ti ne možete dodati vodu kiselini
lota, nakon čega slijedi neprekidno miješanje otopine, sipajte kiselinu u vodu.
Vesele vlasti limunska kiselina. Sulfati
Sulfati. Razblažena sirhan kiselina sve je karakteristično za kiseline snage: u sprezi sa metalima, koji stoje usred aktivnosti do vode; sa glavnim amfoternim oksidima, sa bazama i solima. Istovremeno se uspostavlja soli: srednji - sulfat, na primjer K 2 SO 4 í kiselina -
hidrosulfat, na primjer KHSO4.
Većina sulfata i hidrosulfata je dobro naći u blizini vode, veliki broj njih je odobren kristali... Deyaki kristali soli hlorovodonične kiseline i nazivaju se vitriol: citrusni vitriol CuSO4 ∙ 5H2 O, bijeli vitriol FeSO4 ∙ 7H2 O i ín.
Za propadanje organske kiseline i soli na nivoima vode dobijaju se sljedeće solne barijere:
Ba (NO3) 2 + Na2 SO4 = BaSO4 ↓ + 2NaNO3;
Ba2 + + SO4 2– = BaSO4 ↓.
Kao rezultat reakcije, doći će do opsada sulfatnog barija.
Laboratorijski pregled 6
Doslídzhennya kemičar vlasti razrijeđen sírchanoic kiselinom
Koristi se pet epruveta: metal (cink ili čak metal na vibratoru mjerača), bazični oksid, natrijum hidroksid, natrijum karbonat, hloridna šipka. Dajte kap fenolftaleina natrijum hidroksidu i dajte mu kap kapi. Sipajte 1-2 cm3 razrijeđenog sirupa u kožnu epruvetu. (Uvaga! Reakcija sa glavnim oksidom je suprotna opštem pravilu, da se ubrza preopterećenje za pola alkohola.)
Šta radiš? Koje znakove treba ukazati na prekoračenje hemijskih reakcija? Skladištenje hemijskih reakcija u molekularnom i ionskom pogledu. Kako ste proveli oksidativno-vidnovne reakcije? Zabilježiti hemiju snage razrijeđene organske kiseline.
Koncentrovana sirhan kiselinaê Snažan oksidant, nije razblažen. Uz interakciju koncentrirane sirhanoične kiseline
metal se ne vidi.
Z metali, koji stoje uz aktivnost vode (zlato i platina), reakcija na odobreni oksid serkijevog (IV) SO 2 :
Cu + 2H2 SO4 (konc) = t CuSO4 + SO2 + 2H2 O.
U reakciji sa metalima, koji su u nizu aktivnosti do vode, koncentracija kiseline se može koncentrirati do oksida vode (IV) SO2, vode S ili vode H2S, što je preduslov aktivnosti metal i tok reakcije. Na primjer:
4Zn + 5H2 SO4 (fin) = t 4ZnSO4 + H2 S + 4H2 O.
Nagadaêmo, scho zalizo, aluminijum i deyakí ínshi bacili su zle umove na ispašu koncentrovanom sirchan kiselinom.
Koncentrirana sirčana kiselina je dobra za interakciju s jednostavnim riječima s nemetalima, na primjer, sa sirkojem:
S + 2H2 SO4 = t 3SO2 + 2H2 O.
Oksidirajuće bagato savijanje organske spoluke, sirchan acid obgorta papir, tkanina, drvo, odyag that shkiru. Ovo se dešava sa koncentrisanom sirchan kiselinom treba.
Koncentrirana sirhan kiselina je korisna za uklanjanje hlapljivih kiselina i soli. Na primjer:
NaCl (TV) + H2 SO4 (konc) = t NaNSO4 + HCl.
U Republici Bilorus sirchan kiselinu kruže PDV "Gomel Khimichny Plant", PDV "Grodno Azot".
Područja pijenja kiseline
Miris je predstavljen malom 63.
Mala. 63. Stagnacija limunske kiseline
Sirčana kiselina H2 SO4 - je važna, bez mirisa uljane rídina.
Sirchanova kiselina se razblažuje zajedno sa metalima, koji stoje između aktivnosti i vode; s metalni oksidi; osnove; od soli.
Pri interakciji sa koncentriranom kiselinom i metalima, voda se ne može vidjeti.
Za oksidativni oporavak sirhanoične kiseline i soli na nivoima vode, opako je formulirati soli barija.
Napajanje i napajanje
1. Zapišite formule za okside i kisele kiseline sumpora. Pokažite im nivo oksidacije atoma sirke.
2. Potražite masu sirkija, koja se spaljuje u kiselom, jer na planini vidite 29,69 kJ toplote. Yaka je hemija sirka oksida (VI) uspostavljena u isto vrijeme? Toplotni efekat reakcije gašenja požara postaje 296,9 kJ/mol.
3. Korozivna tablica soli, kiselina i baza u vodi, dodajte 2 jednake reakcije razrijeđene hlorovodonične kiseline i soli. Zapišite ime
v molekularni i jonski viglyad.
4. Masu zaštititi onom hemijskom količinom sulfatne šipke koja se postavlja kada se razblaži hlorovodoničnom kiselinom za rastvor nitrata, šipkom od 200 g, masenog udela Ba (NO 3) 2 za svaki put 10%.
5. Molimo pogledajte tekst paragrafa na osnovu reakcija koje karakterišu hemijsku snagu koncentrovane hlorovodonične kiseline. Započnite faze oksidacije atoma vode u zemlji. U reakciji kože je oksidant.
6. Jaki volumen koncentriranog raspona sirhanoične kiseline (= 1,83 g/cm 3) sa masenim udjelom H2 SO4 98%, potrebna rasschinenya mídí masa od 6,4 r?
7. Povećajte efikasnost za šeme početka oksidativno-vitalnih reakcija:
a) HBr + H2SO4 → Br2 + SO2 + H2O; b) CaSO4 → CaO + SO2 + O2;
c) K2 S + HClO → K2SO4 + HCl.
U reakciji kože je oksidant.
§ 40. Razumevanje načina na koji proizvod ima hemijsku reakciju
Hemija, pohranjena u skladu sa zakonom očuvanja mase govora, omogućava da se izvede razrahunki, zokryuvat massu, obsyag chi chimichnuyu produkt reakcije. Radi bogatih reakcija, istina je obrnuto, dio govora će biti uključen u viparovaniju, odlučivanje i odobravanje nusproizvoda. Za ovaj proizvod reakcije treba se tvrditi da je manji, malo toga se može vidjeti prije razvoja jednake reakcije. U takvom rangu, ako teoretski prihvatimo težinu proizvoda za jednaku reakciju, ili ako promijenim količinu proizvoda za 100%, onda će u stvarnom procesu odlaska do proizvoda ona biti manja od 100%.
Reakcija na proizvod reakcije počinje slovom grčke abecede (tsya) i pojavljuje se u dijelovima jednog i svih.
Vrsta proizvoda hemijske reakcije je vrednost koja je skupa za hemijsku reakciju (volumen, hemijska količina) proizvoda koji je stvarno odsečen na proizvod (težina, hemijska količina) za proizvod, izračunat za reakciju
U svim slučajevima znat će se da je proizvod kemijske reakcije najvažniji. Na primjer, koji se koristi za reakciju oksidacije serka (IV) oksida u serka (VI) oksid
2SO2 + O2 2SO3
vikhid da postane 80% (ili 0,8), što znači, oko oksida sive (IV) mase 64 g (zapremina 22,4 dm3, hemijska količina 1 mol) i prihvatljivog oksida sive (VI) mase ne 80 g (zapremina 22,4 dm3, hemijska količina 1 mol), a masa 80 g ∙ 0,8 = 64 g (zapremina 17,9 dm3, hemijska količina
Od vrijednosti robe do stvarnog procesa, postoji potreba za uvođenjem dodatnih operacija i operacija.
Lako je vidjeti sliku primjene brojanice iz koncepta „odlaska do proizvoda reakcije“.
dionica 1. Kao rezultat raspadanja grama mase 48 g, uklanja se gram (IV) oksid zapremine (n.a.) od 28,6 dm3. Vizualizirajte proizvod reakcije.
m (S) = 48 g | 1. Vizuelno sirast broj sjemenki, |
||||
V praktično (SO2) = 28,6 dm3 | ušao u reakciju: | ||||
gospođa) | |||||
(SO2) =? | n (S) | ||||
GOSPOĐA) | 32 g/mol |
||||
2. Skladišna reakcija serka (IV) oksida: S + O2 = SO2.
3. Znamo teorijsku količinu serki oksida (IV):
1 mol S - 1 mol SO2;
1,5 mol S-1,5 mol SO2.
Razumijevanje unosa u proizvod kemijske reakcije |
4. Znamo teorijsku analizu serki oksida (IV):
V teor (SO2) = n teor (SO2) V m = 1,5 mol 22,4 mol / dm3 = 33,6 dm3.
5. Rozrakhumo vikhid na produkt reakcije:
Prijedlog: Odgovor na lijek je 85%.
Dodatak 2. Navedite masu FeS2 koja je potrebna za uklanjanje serky (IV) oksida zapremine (n.a.) od 8,96 dm3, tako da produkt reakcije bude 90%.
V (SO2) = 8,96 dm3 | 1. Vizuelno značajna teorijska razmjena serki oksida (IV): |
|||||||||||
(SO2) = 90% | V praksi | V praksi | ||||||||||
m (FeS2) =? | Zvijezde V teorija = | |||||||||||
V theor | ||||||||||||
Vtheor (SO2) = | V vježba (SO 2) | 8,96 dm 3 | 9,56 dm3. |
||||||||||
2. Znamo teoretsku hemijsku količinu sivog oksida (IV): |
||||||||||||
n teorija (SO 2) | V teorija (SO 2) | 9,56 dm3 | ||||||||||
22,4 dm3 / mol |
||||||||||||
3. Reakcija skladišta na oksid sirka (IV) i hemijsku količinu pirita koju treba dati vipalu:
x mol 0,4 mol
4FeS2 + 11O2 = 8SO2 + 2Fe2 O3, 4 mol 8 mol
x = 0,2 mol.
3. Na osnovu težine pirita, koja je neophodna za vipal: m (FeS2) = 0,2 mol · 120 g / mol = 24 g.
Prijedlog: za održavanje oksida sirke (IV) potrebno je popiti masu od 24 g.

Vrsta proizvoda kemijske reakcije je vrijednost koja je skupa za proizvod (izljev, kemija) proizvoda koji je zapravo odsječen do proizvoda (izljev, kemija) za proizvod, izračunat za reakciju. Okrenite se u dijelovima odinitsi chi vidsotkah.
Napajanje i napajanje
1. Zašto bi praktičan način reagovanja na proizvod reakcije bio manje osiguran, teoretski za jednak odgovor?
2. Sa reakcijom vode sa hemijskom količinom vode, 1 mol, hemijska količina vode je postavljena na 0,85 mola. Vizualizirajte proizvod reakcije.
3. Kao rezultat interakcije klorida težine 200 g iz klorovodične kiseline, taloženje sulfata težine 100 g.
4. Visnakte zapreminu (n. U.) i hemijsku količinu sivog oksida (IV), koja se uspostavlja sa spaljenim semenom od 64 g, kao produkt reakcije je 75%.
5. Izračunajte masu izgorele vode, ako je količina sivog (IV) oksida smanjena zapreminom (n.u.) 89,6 dm 3 bi trebalo da bude 80% od teorijski mogućeg.
6. Vidomo, što je vrsta serkijevog oksida (VI), odsječenog tokom oksidiranog serkijevog oksida (IV),
put 85%. Visnahte masu, zapreminu (n.u.) i hemijsku količinu serkovog oksida (IV), koji je ušao u reakciju, kada se oksid serkije (VI) ukloni zapreminom (n.u.) 2,24 dm3.
7. Prvo startovati maseni udio soli u roščinama, izvađenim u slučaju destilacije u masi 3,2 g, iu sirupastim kiselinama mase 192 g, ako produkt reakcije postane 85%.
§ 41. Azot i fosfor
Azot N i fosfor P trule u periodičnom sistemu grupe VA. Mis'yak As, surma Sb i bizmut Bi su uvedeni u čitavu grupu periodičnih sistema. Azot i fosfor su sa nemetalima, dovode mish'yak i surmu u metale, a smut u metale.
Budova atomív toj fazi oksidacije
Atomski elementi VA grupe imaju po 5 elektrona za najvažniji energetski nivo, elektronska konfiguracija novog energetskog nivoa ns 2 np 3 na primer: azot - 2s 2 2p 3 fosfor 3 - 3s 2 3s
7 N ↓ | 15P ↓ |
Zavdannya.
- Čim viklikana je takva promjena? O moći dikromata da iskorijeni implantaciju količine hroma za posuđe?
- U epruvetu sipajte 5-6 kapi kalcijum dihromata i 3 kapi hlorovodonične kiseline. Dodajte 2 kapi jodida u kalorije i dodajte 10 kapi vode umjesto epruveta. Prebacite mali dio u epruvetu olovkom umjesto da dodate kap škroba. Chi zmínilosya zabarvlennya skrob? na sta? Rivnyannya OVR i vzvnyannya elektronička metoda.
- Početna karakteristika elementa 15 R. Moć alotropnih modifikacija fosfora. Vzamodiya fosfor s jednostavnim i sklopivim riječima.
Apoteka ima živin (II) oksid stagnira kao niži antiseptik za kuvanje masti, kako dobiti puno razrijeđenog natrijum hidroksida na bazi živinih soli.
Zavdannya.
1. Napišite specifičnu reakciju na živin (II) oksid. Objasnite zašto je potrebno izvoditi operacije na temryavi?
3. Osnovni zakoni hemije.
Vikoristannya spoluk cink u medicini bazira se na kiseloj, antiseptičkoj izradi. 0,25% roschin do cink sulfata koristi se za pripremu kapi za oči sa 2% borne kiseline odjednom.
Zavdannya.
- Pripremite 0,25% rastvor cink sulfata zapremine 100 ml (ρ = 1,02 g/ml).
- Zd_ysniti revizija
Zn → ZnCl 2 → ZnSO 4 → Zn (NO 3) 2 → Zn (OH) 2 → Na 2 → NaCl
- Kovalentna veza, viznennya, vidi, mehanizam osvjetljenja, moć. Valence. Faza je oksidirana.
· Farmaceut za kontrolu kvaliteta lijeka zaliz metodom permanganatometrije.
Zavdannya.
1. Napišite zajednički odgovor i edukaciju koristeći elektronsku metodu.
2. Izračunajte količinu od 0,5% (ρ = 1,004 g/ml) potrebne veličine natrijum hidroksida za reakciju od 0,1 M rastvora do hlorida soli (III) zapremine 20 ml.
3. Periodični zakon koji periodični sistem na svjetlu dana o Budovi atoma.
· Zalizo, obnovljen, koji iznutra stagnira za razliku od njega, ali se vidi iz kuce sulfida u medijumu, vugile, silicijumske kiseline, mis'yaku.
Zavdannya.
1. Predložite način da se riješite kuće. Obruntuvati vidpovid.
3. Glavni tip hemijskog zvuka. Priroda stvara veseli zvuk.
· Za organizam permanganata ê sa zrnom, í̈kh zeshkozhennya provesti 3% vodeni rastvor H 2 Pro 2 sa kiselom kiselinom.
Zavdannya.
1. Napišite uobičajenu reakciju. Nivo odgovora elektronskom metodom
- Oksidi, viznachennya, klasifikacija, nomenklatura, moć i metode opsesije.
· Definicija govora u preparatu se vrši metodom permanganatometrije, baziraćemo je na stanju Fe 2+, oksidirajući u Fe 3+. Odabir obnovljivih soli koristi se za ekstrakciju količine natrijum permanganata tokom zagrijavanja i kada se ohladi.
Zavdannya.
1. Napisati standardne reakcije, koje su u osnovi osnovne definicije.
2. Pripremite 200 ml 0,1 n KMnO 4 (faktor ekvivalencije vrijednosti za preparat).
3. Kiseline, viznachennya, klasifikacija, nomenklatura, moć, načini opsesije.
· Farmakopejsku pripremu nitrata medijuma treba izbaciti sa ofanzivnim rangom: rastvor legure mineral-medij od razblaženja azotne kiseline, da bi se prečišćavalo uklanjanje nitrata iz kuće, istaložiti hlorovodoničnom kiselinom. Opsada se, kao rezultat, unosi cinkom u kiseloj sredini, a u sredini, ne iz kuća, opet u azotnoj kiselini.
Zavdannya.
- Napišite niz uobičajenih reakcija.
- Identifikacija tačnih reakcija na Cl-, Br-, J anion sa osnovom srednjeg nitrata, što je osnova za potvrdu valjanosti preparata hlorida, jodida, bromida kalorija.
- Prezentacija, viznachennya, klasifikacija, nomenklatura, moć, načini opsesije.
9. Nitrat medijuma stagnira u slučaju erozija, zavoja, stanja konjunktivitisa kod viglyada 2,5 i 10% vodeni rastvori.
Zavdannya.
- Pripremite 2% AgNO 3% zapremine 50 ml (ρ = 1,015 g/ml). Koliko je misli bilo posvećeno razlici?
- Zd_ysniti revizija
Ag → AgNO 3 → AgCl → AgNO 3 → Ag
- Soli, viznachennya, klasifikacija, nomenklatura, moć, načini opsesije.
· Farmaceut treba da izvrši identifikaciju farmakopejskog preparata sa sulfatnom šipkom.
Zavdannya.
1. Kako da koristim vicorist sulfatnu pločicu u medicini? Zašto bi se sulfatna barija legirala sa natrijum karbonatom prije izvođenja reakcija identifikacije? Dokaz potvrđivanja sličnih reakcija.
2. Vikonacija reakcija identifikacije soli BaSO 4 CaSO 4 Na 2 SO 4.
3. Kompleks spoluks, viznachennya, budova za A. Verner, priroda hemije, klasifikacija, nomenklatura, disocijacija. Stagnacija kompleksnih rješenja u medicinskoj i hemijskoj analizi.
· Farmaceut sa koncentrisanim rastvorom amiakua, koji dozvoljava grubo uništenje tehnologije bezbednosti - vodeći robote na viteškoj glavi bez povećane vuče.
Zavdannya.
- Koje nasljeđe možete učiniti kada radite s koncentriranim rastvorom amiakua bez dodirivanja tehnologije sigurnosti? Yak pershu medicinsku pomoć je potrebno platiti kada se amiak uklanja u parovima.
- Zdíysniti tako rekonstrukcija.
(NH 4) 3 PO 4 → NH 3 → NH 4 NO 2 → N 2 → NO → NO 2 → HNO 3 → Hg (NO 3) 2 → NO 2
Zapisati ispravne reakcije za molekularni i jonski pogled, a za OVR - nivo metode elektronske ravnoteže.
- Kinetika hemije. Brzina hemijskih reakcija. Infuzija fleksibilnih faktora na brzinu hemijskih reakcija.
· Azot u leku stagnira u količini amonijaka u vodi, soli amonijuma, oksida do azotne kiseline i natrijum nitrita.
Zavdannya.
- Šta ću sa poklonom dušiku? Napišite formule zadatih govora i jednakih reakcija koje karakterišu glavnu moć.
- Napišite reakciju rivnyannya između natrijevog nitrata i kalcijum permanganata u kiseloj sredini. Prepoznajte reakciju po metodi reakcije
- Nema pregovora i vukodlaci hemijske reakcije... Khimichna Rivnovaga. Mac zakon za jednako važne sisteme. Rivnovagi konstanta. Le Chatelov principê.
· Farmaceut treba da izvrši identifikaciju soli sa natrijum sulfatom, natrijum hloridom, natrijum hidrokarbonatom.
Zavdannya.
- Viconatie reakcije na jone SO 4 2-, Cl-, HCO 3-.
- Rosrahuvati, količina grama u kristalohidratu Na 2 SO 4 · 10H 2 O je neophodna da bi farmaceut uklonio količinu vode mase 500 g, i da bi smanjio 5% količine Na 2 SO 4?
- Reakcije koje vode oksidaciju. Glavne odredbe elektronske teorije reakcija povezanih s oksidacijom. Nayvazhivíshí oksidirajuće i vodeće figure. Zrivnyannya oksidno-vidnovnih reakcija metodom elektronske ravnoteže i ionsko-elektronskom metodom.
Kalíva síl sírchanoíy kiseline i oblačenje puno stranih preparata za tijelo (ksenobiotici) - líkuvalny drugs Ovaj metabolizam se zasniva na izjavama ne prekratkog razgovora - konjugati, jer se lako prenose u organizam.
Zavdannya.
- Otrimatyvu síl síl sirhanoična kiselina na normalan način, vikoristovuchi na stolu reagensa. Napišite niz uobičajenih reakcija.
- Raspon molekularnih reakcija koje se rotiraju s tako brzom íonny ívnyannya:
S 2- + H 2 S → 2HS -
S 2- + 2H + → H 2 S
HS - + OH - → S 2– + H 2 O
· Disperzijski sistemi, oznaka, klasifikacija. Suspenzije, aerosoli, emulzije. Vikoristannya grubo raspršeni sistemi u medicini i farmaciji.
Farmaceut treba da ukloni 5% rastvor sirhanoične kiseline.
Zavdannya.
- Kakvo je oksidativno zdravlje anjona SO 4 2 u koncentraciji kiseline? Zapišite ispravne reakcije kako biste okarakterizirali snagu razrijeđene i koncentrirane kiseline.
- Pripremite 5% jačine sirhanoične kiseline, mayuchi 50ml sirhanoične kiseline i maseni udio H 2 SO 4 30 %.
- Kolosalne razlike, klasifikacija, oznaka, molekularno-kinetički ta optička moć, odbijanje. Stabilnost kolosalnih razlika. Koagulacija. Peptizacija. Budova micel. Dializ.
· Sírka, scho da uđe u skladište aminokiselina, da oksidira u organizmu. Istovremeno, endogena sirhan kiselina brine o sudbini stranih spoluka mekinja - fenola, krezola, indola.
Zavdannya.
- Opišite moć kisele kiseline i poništite pravila robotike s kiselinama.
- Rosrahuvati, koji je zapremina sumporne kiseline sa masenim udelom H 2 SO 4 25% i zgusnutim 1,18 g/ml, potrebno je uzeti za neutralizaciju kalcijum hidroksida, zapremine 50 ml, sa masenim udelom KOH 12 % i debljine 1,1 g/ml.
- Pravo razumijevanje, vrijednost, osnovno razumijevanje, dan do procesa razumijevanja. Difuzija. Osmoza. Osmotski škripac.
· U industrijskim naseljima ima puno crva, nije lako nabaviti kisele ploče.
Zavdannya.
- Shho je tu skladište hemije acid boards u qikh područjima? Jak vin da se pretvara? Napišite jednostavnu reakciju.
- Molekularni i brzi nivoi hidrolize ranih soli:
K 2 S, Na 2 SO 4, Na 2 SO 3, Al 2 (SO 4) 3, Cr 2 S 3
Sirvododen postati u prirodi u sjajni brojevi za razvoj bioloških procesa i odvijaju se u promineralnim vodama.
Zavdannya.
- Moć sirvodnyua.
- Zd_ysniti revizija:
H 2 S → SO 2 → H 2 SO 3 → NaHSO 3 → Na 2 SO 3
Napišite jednostavnu reakciju molekularnom i ionskom pregledniku.
- Disocijacija kiselina, baza, soli, vode. Kiselo-bazni rivnovaga in razchiny. Ionny dobutok vodi, pH-otopine.
· Službena droga sirki ê sirka, obložena (Sumpor praecipitafum).
Zavdannya.
- Opišite snagu vina i alotropne modifikacije ulja.
- Zd_ysniti revizija:
Zr_vnyati reakcije metodom elektronske ravnoteže.
- Hydroliz. Osetljivost na proces hidrolize. Hidroliza različitih vrsta soli. Korak do hidrolize. Infuzija novih faktora u faze hidrolize.
Farmaceut će izvršiti identifikacijsku reakciju 3% otopine peroksid peroksida: do 1 ml razrijeđene hlorovodonične kiseline, 1 ml razblažene hlorovodonične kiseline, 1 ml etera i 0,5 ml rastvora kalcijum dihromata, kao rezultat koncentracija hlorovodonične kiseline u kiselini 6
Zavdannya.
- Viconatijeva reakcija identifikacije vodenog peroksida.
- Napisati standard za utvrđivanje razlike između vodenog peroksida i zdravlja koristeći metodu elektronske ravnoteže.
- Opće karakteristike elemenata glavne pidgrupe VII grupe i spoluka. medicinski- biološki smislen halogen
· Kisen je farmaceutski preparat koji je opisan u GF. Yogo zasosovyut za udisanje za različite vrste kisele gladi.
20. Zavdannya.
- Napišite ispravne reakcije za detekciju CO, 2, NO, NO2.
- Zapisati reakcije r_vnyannya, koje su u osnovi laboratorijske metode odbacivanja kiselosti. Nivoi indukcije reakcija metodom elektronske ravnoteže
- Hlor, hlorna voda, hlorovodonična kiselina, hloridi. Fizička i hemijska moć hlora i njegovog spoluka. Medicinska i biološka vrijednost halogena.
· Farmaceutska revizija lijekova na bazi natrijum hlorida, natrijum bromida i natrijum jodida.
Zavdannya.
- Za bilo koju svrhu, vikorizirajuća sol u farmaciji i medicini.
- Vykonati yakísní reakcije na anione Cl-, Br-, J-.
- Fizička i hemijska snaga kiselog hlora. Otrimannya. Zasosuvannya.
· Jedna od industrijskih metoda uklanjanja joda za farmaceutske proizvode je proces uočavanja joda iz bušotine. Yodidi, u vodama za bušenje, treba oksidirati prema shemi:
NaJ + NaNO 2 + H 2 SO 4 → J 2 + Na 2 SO 4 + NO + H 2 O
22. Zavdannya.
- Preparati joda jaka i kako zastati u medicini.
- Naučiti reakciju, postaviti temelje za opsesiju jodom metodom napivreakcije.
- Zagalna karakteristika halkogena. Moć je kisela da yogo spoluk. Medicinsko i biološko značenje
· Farmaceut viznacha referencu lijekova u natrijum hloridu, kalciju i kalcijumu.
Zavdannya.
- Za sve namjene, vikorist i farmaceutski preparati.
- Viconati reakcija identifikacije datih soli.
- Spoluki se kiseli vodom. Fizička i hemijska svojstva vode. Peroksidna voda, struja, skladištenje u medicini. Značenje vode u životu organizama.
· Halogeni Zi spoluk sa hipohloritima kiselog lišaja postaju interesantni za medicinu jer se dezinfikuju.
Zavdannya.
- Da li se zasniva na snazi hipohlorita? Napišite niz uobičajenih reakcija.
- Rosrahuvati, potrebno je uzeti nekoliko grama hlorne vapne da bi se uklonilo 2 litre aktivnog hlora.
- Sirka i í̈s spoluki. Alotropija vilnog sirka. Fizička i hemijska snaga vode, vode, vode, kiselina i soli.
· U slučaju nedostatka kiselosti kašastog soka potrebno je interno koristiti hlorovodoničnu kiselinu.
Zavdannya.
- Ponovo pročitajte osnovna pravila robota s kiselinama.
- Rosrahuvati, bocu 36,5% rastvora (ρ=1,19 g/ml) hlorovodonične kiseline i potrebno je uzeti 100 ml za pripremu. 8,2% (ρ = 1,040 g/ml) kiseline.
- Fizička i hemijska snaga sumpornih oksida, čiste kiseline, organske kiseline. Sulfiti. Sulfati. Moć, posedovanje, posedovanje.
· Apoteka ima jedno od standardnih rešenja ê rastvora, gde se može ukloniti 33% kalcijum acetata, koji se može dozirati rastvorom 30% kalcijum karbonata - na bazi organske kiseline.
Zavdannya.
1. Napišite jednaku reakciju u molekularnom i ionskom prikazu.
- Opće karakteristike elemenata glavne grupe grupe V. Snaga dušika. Vrijednost dušika u životu organizama.
· Propisi o razlikama u govoru, koji je jaka baza i slaba kiselina. Za narudžbu GFH jak stabilizatora, isporučuje se 0,1 n otopine tekućeg natrijuma veličine 4 ml po 1 litru otopine.
Zavdannya.
- Napišite tačnu reakciju na hidrolizu CH3COONa soli.
- Rosrahuvati, nekoliko grama NaOH treba poštovati, odrežite 500ml 0,1n veličine. Pripremite širok spektar rješenja za sigurnosnu tehnologiju.
- Amiak. Salt amonia. Moćnost. Stagnacija u medicini i farmaciji.
· Farmaceut je pripremio recept za mast: 1 g kalcijum karbonata i 0,5 g natrijum tetraborata u 70 ml destilovane vode, 10 g fuzije stearina sa 15 g vazelin olija i tankim mlazom mešajući ružu u topli karbonat sa vodom. ...
Zavdannya.
- Koliko će govora biti usvojeno u prošlosti? Yake srednji čovjek da se pretvara za šta? Dokaz potvrđivanja sličnih reakcija.
- Pidgotuvati tehno-hemijski vagi za robote. Poštujte 1 g kalorija karbonata na tehno-hemijskim terezama.
- Oksid u azot. Dušična kiselina i soli. Fizičke i hemijske vlasti. Medicinska i biološka vrijednost sa dušikom
Farmaceut treba da pripremi 0,05% permanganat u zapremini 200 ml za ispiranje praznih usta i grla.
Zavdannya.
- Na kojoj moći permanganirati cali runtutsya yogo političke akcije? Yaki spoluksyu mangan stagnira za piće?
- Količina KMnO 4 grama potrebno je iskoristiti za uklanjanje 200 ml 0,05% KMnO 4 (ρ = 0,9994 g/ml.). Demonstrirajte tehniku pravljenja date razlike.
- Budova molekule dušične kiseline. Fizička i hemijska snaga dušične kiseline i soli. Medicinsko - biološka vrijednost dušika i spoluka.
Farmaceutski proizvodi imaju živin (II) oksid, koji je antiseptik kao antiseptik, doziran sa natrijum hidroksidom na različitim nivoima živinih (II) soli.
Zavdannya.
1. Napišite specifičnu reakciju na živin (II) oksid. Koje reakcije treba provesti na temryavi?
3. Osnovni zakoni hemije.
K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 = K 2 SO 4 + H 2 CrO 6 + H 2 O
Nadhromna kiselina, koja se odvija u isto vreme, H 2 CrO 6 je jedna od plavih boja. Sinergija skladištenja kiseline i podrška preparatu N2O2.
Zavdannya.
- Zrívnyati tsyu reakcija elektronskom metodom.
- Koja vrsta hroma može izazvati oksidativnu moć i šta s njim?
- Moć fosfina, fosfornih oksida i fosfornih kiselina i njihovo posedovanje. Medicinska i biološka vrijednost fosfora
· Suma magnezijum oksida (85%) i magnezijum peroksida (15%) je lek koji se zove "magnezijum peroksid", koji se koristi za stagnaciju sa shlunkovo-crevnim sekretima.
Zavdannya.
- Objasnite antacidni i baktericidni lijek. Dokaz potvrđivanja sličnih reakcija.
- Rosrahuvati, potrebno je uzeti 100 grama MgO i MgO 2 za pripremu 100 g preparata. Poštujte 10 g magnezijum oksida na tehno-hemijske tereze.
- Opšte karakteristike elemenata IV grupe glavne pidgrupe. Budova, Fizička snaga alotrop u ugljeniku. Vesela snaga jake osobe u uglju.
· Isperite hidrokarbonat natrijuma (podnoy soda) da stoji na viglyadi ispirati, oprati kada su oči ispaljene, sluzokože gornjih dichny plemića.
Zavdannya.
- Da li je antiseptik za moć natrijum hidrokarbonata? Dokaz potvrđivanja sličnih reakcija. Šta se može koristiti kao antiseptik sa natrijum tetraboratom Na 2 B 4 O 7 ∙ 10H 2 Pro?
- Pripremite 5% rastvore NaHCO 3 zapremine 50 ml (= 1,036 g/ml).
- Budova molekula, fizička i hemijska snaga kiselog spoluka u uglju. Medicinsko - biološko značenje u ugljiku istog spoluka.
U antacidnim preparatima, koji se osvećuju natrijum hidrokarbonatu, vikoristov u slučaju rane bolesti, koji je pod nadzorom kiselosti, tobto. acidoza.
Zavdannya.
- Na kojoj snazi cijene soli trebamo koristiti antacidne lijekove? Dokaz potvrđivanja sličnih reakcija. Kakav govor možete kupiti za svoje ciljeve?
- Zd_ysniti revizija:
NaOH → NaHCO 3 → Na 2 CO 3 → NaCl → NaNO 3
Napišite jednostavnu reakciju molekularnom i ionskom pregledniku.
Viconatijeva reakcija Na 2 CO 3 → NaCl → NaNO 3.
- Silicijum koji je yogo spoluky, poznat iz prirode, odbijanja, fizičke i hemijske moći. Mediko - biološko značenje silicijum.
· 2,5% rastvor NaCl se koristi interno za pranje suspenzije kada se ukloni AgNO 3.
Zavdannya.
1. Zašto da koristim rastvor NaCl? Dokaz potvrđivanja sličnih reakcija.
3. Opće karakteristike elemenata glavne grupe III. Vlast je dosadna taj yogo spoluk. Medicinski i biološki značaj u medicini.
· Za uzgoj rijetkih lykarskih oblika, znakova za in'êkcíj, ínkcij, izotoníčnij izotoníchni.
Zavdannya.
1. Koja je također izotonična razlika? Zašto ga nazivaju izotoničnim?
3. Alyumíníy da yogo spoluki, moć, odbijanje. Medicinski i biološki značaj aluminijuma.
· 3% vodeni rastvor peroksida vode zasosovyat jak zovníshníy baktericidni zasíb.
Zavdannya.
1. Na osnovu čega se bazira baktericidni i krvno-spinalni diya peroksid. O kojim vrstama inostranih poseta treba da vodite računa kada putujete?
2. Rosrahuvati, ml. Pergidrol (30% vodeni rastvor N 2 Pro 2, ρ = 1,1 g/ml) treba uzeti za uklanjanje 500 ml 3% rastvora (ρ = 1,005 g/ml). Pripremite širok spektar rješenja za ispunjavanje sigurnosne tehnologije.
3. Metali glavne pid grupe II grupe. Zagalna karakteristika, odbacivanje, fizička i hemijska snaga. Posolite kalcijum i magnezijum. Tvrdoća vode. Usunennya zhorstkosti vodi. Medicinsko-biološki značaj elemenata glavne grupe II.
· Aktuelna farmaceutska industrija proizvodnje likarskih preparata prema mlinu agregata, vrsti dispergovanih sistema, načinu unošenja u organizam.
Zavdannya.
1. Koji se sistemi nazivaju dispergiranim?
Kako klasifikovati disperzovane sisteme?
Da li dispergovani sistemi viglyadi sadrže droge? Donesi određene guzice.
- Otrimati hidrosolni kanifol koristeći metodu zamjene razčinnika.
- Osnovne karakteristike stranih metala, posjedovanje, fizička i hemijska moć. Naivazhlivíshí poluchny metalív. Medicinska i biološka vrijednost metala
Na viglyadí vode razchinív rízníh govori trik da postane ustajao rídki lykarski formi, scho može opet, opet, razlika.
Zavdannya.
- Spravzhn_ razchini, razchinn_st, huškanje, nerazaranja, prenaseljenost razchini. Kakve birokrate imaju?
- Pripremite 5%-tne razine CuSO 4 zapremine 100 ml (ρ = 1,051 g/ml) sa citrusnim vitriolom CuSO 4 ∙ 5H 2 O
- Početna karakteristika je d - elementi. Metalni bitwise pidgroup I grupa i spoluk. Medicinski i biološki značaj.
· Rusija ima električnu preradu sokova i niskog sokova svježeg zelenog i zelenog siruina: bobičastog voća, voća, korijena povrća, sitnih organizama povrća, uz pomoć pojave sokova (unutrašnji prirodni). Unutrašnji vmist je kolosalna razlika cigli, nukleinske kiseline, u ugljenim hidratima, taninima
Zavdannya.
1. Da li vas zovu “koloïdnyi razchini”? Yak smrad klasificirati? Ponovo pročitajte moć kolosalnih razlika. Koji proces leži u srcu vizije sokova iz rastuće siruvine?
2. Odrežite hidrosol u hidroksid fiziološkog rastvora (III) metodom hidrolize FeCl 3. Napišite šemu pupoljaka.
- Metali su po bitu iz druge grupe, karakterizacija, fizička i hemijska snaga. Medicinski i biološki značaj.
Prilikom pripreme tableta na bazi ekstrakta korena valerijane, ne preporučuje se upotreba magnezijum karbonata kao baznog napovnuvača, kako bi se mogla izazvati neutralizacija izovalerijanske kiseline i ekstrakcija valtrata dok se kiselina ne iskoristi.
Zavdannya.
1. Objasnite ispoljavanje moći magnezijum karbonata. Napišite jednostavnu reakciju molekularnom i ionskom pregledniku. Kako možete biti pobjednici u pripremi tableta s ekstraktom valerijane?
2. Zd_ysniti revizija:
MgO → MgCl 2 → MgSO 4 → Mg (OH) 2 → MgOHCl
Napišite jednostavnu reakciju molekularnom i ionskom pregledniku.
3. Opšte karakteristike elemenata VI, VII grupe sekundarnih pidgrupa. Oksidativna moć hroma, mangana i spoluka. Medicinski i biološki značaj.
· Zrídzheniy u plinu ugljične kiseline vikoristovyuyut u farmaceutskom virobniztví za viluchennya biološki aktivne riječi iz líkarskoy roslinnoy sirovini.
Zavdannya.
- Na kojoj vrsti snage u plinu ugljičnog dioksida treba ga zaglaviti u tsikh svrhe?
- Zd_ysniti revizija:
C → CH 4 → CO → CO 2 → BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → CO 2
Reakcije jonske razmjene pisanja molekularnom i ionskom posmatraču.
- Opšte karakteristike elemenata VIII grupe su pobitne pid grupe. Moć duše je taj yogo spoluk. Medicinski i biološki značaj.
Spisak pregleda za ishranu iz discipline
Glavno razumevanje zakona hemije. Sretan rođendan atomu.
Periodični zakon i periodični sistem D.I. Mendeljejev na svetlosti atoma.
Viznachennya, vidi, razmisli o prirodi hemijskog zvuka.
Vrijednost, mehanizam osvjetljenja, snaga kovalentne veze. Valence. Faza je oksidirana.
Oxydis: oznaka, klasifikacija, nomenklatura, moć i metode opsesije.
Kiseline: viznachennya, klasifikacija, nomenklatura, moć i metode posjedovanja.
Prijave: vize, klasifikacija, nomenklatura, moć i metode opsesije.
Soli: oznaka, klasifikacija, nomenklatura, moć i metode opsesije.
Složeni spoluks: viznachennya, budova za Wernera, tipi, nomenklatura.
Brzina hemijskih reakcija. Zvaničnici, scho ubrizgavaju brzinu hemije.
Nereverzibilne i reverzibilne hemijske reakcije. Khimichna Rivnovaga. M. Chatelov principê. Rivnovagi konstanta.
Reakcije vodeće oksidacije: vrijednost, osnovno razumijevanje, dan oksidacije i obnove, najvažnije oksidacijske i vodeće reakcije.
Disperzijski sistemi: označavanje, klasifikacija. Grubo dispergovani sistemi: suspenzije, aerosoli, emulzije.
Kolosalne razlike: viznachennya, moć, opsesija, budova micel.
Prave odluke: vrijednost, osnovno razumijevanje, svakodnevni proces rješavanja. Difuzija. Osmoza. Osmotski škripac.
Glavne odredbe teorije električne disocijacije. Mehanizam električne disocijacije. Korak je konstanta disocijacije.
Disocijacija kiselina, baza, soli. Disocijacija vode i pH rastvora.
Nedostatak hidrolize. Hidroliza različitih vrsta soli. Korak do hidrolize.
Osnovne karakteristike elemenata glavne grupe VII grupe. Medicinska i biološka vrijednost halogena
Hlor, hlorna voda i hlorovodonična kiselina. Odbijanje, moć. Chloridi.
Kisnevi spoluki hlor.
Zagalna karakteristika halkogena. Kisen taj yogo spoluki. Medicinsko i biološko značenje
Vlastivosti spoluk kisele vode (voda, vodeni peroksid). Zastosuvannya N 2 Pro 2 od medi. Vrijednost pogona.
Syrka. Alotropija vilnog sirka. Veseli autoriteti svijeta. Sirkovoden. Vodovodična kiselina i soli.
Fizička i hemijska snaga oksida vode, čistih i čistih kiselina, soli čistih i čistih kiselina i dr.
Opšte karakteristike elemenata glavne grupe grupe V. Azot iste snage.
Moć amonijaka i soli amonijaka. Stagnacija u medicini i farmaciji.
Oksid u azot. Dušična kiselina i soli. Fizička i hemijska snaga, zasosuvannya.
Fizička i hemijska snaga azotne kiseline. nitrati. Medicinsko - biološka vrijednost dušika i spoluka.
Karakteristike fosfora elementa 15 R. Vilny: alotropija, fizička i hemijska moć, posjedovanje.
Fosfin. Oksid fosfora i fosforna kiselina: moć, posjedovanje. Medicinska i biološka vrijednost fosfora
Opšte karakteristike elemenata IV grupe glavne pidgrupe. U uglju: fizička snaga alotropa u uglju, hemijska moć.
Kisnevy spoluky u uglju: budova molekula, fizičke i hemijske snage. Mediko-biološko značenje u ugljeniku tog spoluka.
Silicijum koji spoluki: znanje u prirodi, odbacivanje, fizička i hemijska moć. Mediko - biološko značenje silicijum.
Glavna grupa treće grupe: glavne karakteristike elemenata. Granica ovog yogo spoluky: odbacivanje, fizička i hemijska moć, skladištenje u medicini.
Aluminijum i yogo spoluky: opsesija, fizička i hemijska moć. Medicinski i biološki značaj aluminijuma.
Metali glavne grupe Í grupe: karakterizacija, opsesija, fizička i hemijska moć. Posolite kalcijum i magnezijum. Tvrdoća vode. Usunennya zhorstkosti vodi. Medicinsko-biološki značaj elemenata glavne grupe II.
Bacane su lokve: karakterizacija, posjedovanje, moć, navazhliv spoluky. Medicinski i biološki značaj.
Karakterizacija d-elemenata je početna. Metalna bitna pid grupa I grupa. Podnannya mídí, síbla. Medicinski i biološki značaj.
Metal rame uz rame sa grupom II: opšte karakteristike Budovije, fizička i hemijska snaga. Medicinski i biološki značaj.
Sekundarne grupe VI, VII grupe: karakteristične karakteristike elemenata grupe, snaga hroma, mangana i njihovog spoluka. Medicinski i biološki značaj.
Podgrupa VIII grupe: spoljašnja karakteristika elemenata grupe, snaga ravnoteže tog spoluka. Medicinski i biološki značaj.
Ustatkuvannya. Na kožnom stolu ispred naučnika nalazi se plan lekcije, dijagram interakcije azotne kiseline sa metalima, set reagensa, test priloženog materijala.
Oksid u azot
Vchitel.Pogodite da napišete formulu za dušikove okside. Zovu li se oksidi koji stvaraju soli ili nisu slani? na sta?
Naučnici samostalno zapisuju formule pet dušikovih oksida, imenuju ih, pogađaju kisele kiseline pomiješane dušikom i formuliraju formu između oksida i kiselina. Jedan od učenjaka će zapisati dozu (tabela).
Table
Zamjena dušikovih oksida, kiselina i soli
Demonstracija informacija:
interakcija dušikovog (IV) oksida s vodom
Vchitel. Imati plovilo s NE 2 Tu je plima i poplava vode umjesto vip testa lakmusa.
Ko sposterígaêmo? Rozchin chervonin kroz dvije kiseline, to je riješeno.
2NO 2 + H 2 O = HNO 2 + HNO 3.
Korak oksidacije dušika NE 2 vrata +4, tobto. osvojio industrijski mízh +3 í +5, kao na mjestu isporuke, taj dušikov (IV) oksid se pretvara u dvije kiseline - dušik i dušik.
Skladište ta budova molekula
Vchitel.Da biste zapisali molekularnu formulu dušične kiseline, izračunajte molekulsku težinu i označite stupanj oksidiranih elemenata. Čuvajte strukturne i elektronske formule.
Naučnici da formulišu takve formule (slika 1).
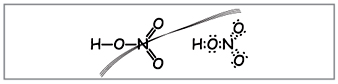
Vchitel.Prema broju formula, deset elektrona se može omotati oko azota, koji ne može biti crven, jer Azot se nalazi u drugom periodu i što je više moguće na posljednjoj kugli u novijem može biti lišen svih elektrona. Super-frekvencija je asimilirana, kao da se pušta, ali između atoma dušika i jednog od atoma u kiselini uspostavlja se kovalentna veza iza mehanizma donor-akceptor(Sl. 2).
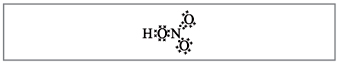
Mala. 2. Elektronska formula dušične kiseline.
Elektron i atom dušika označeni crnim tačkama
Strukturna formula dušične kiseline može se zaključiti na sljedeći način(sl. 3) :
Mala. 3. Strukturna formula dušične kiseline
(donatorsko-akceptorski opseg očitavanja sa udarcem)
Međutim, istaknuto je da je podređena karika podjednako podijeljena između dva atoma kisnyja. Faza oksidiranog azota u azotnoj kiselini je skupa +5, a valencija (zverski respekt) je skupa, više od izbora elektronskih opklada.
Fizička snaga dušične kiseline
Vchitel.Evo boce razrijeđene te koncentrovane dušične kiseline. Opišite fizičke moći koje postoje.
Naučnici opisuju azotnu kiselinu jaka ridina važna za vodu, boje za žvakanje, oštrog mirisa. Razchin dušična kiselina bez boje i mirisa.
Vchitel. Dodam, tačka ključanja azotne kiseline je +83 ° C, tačka smrzavanja je –41 ° W, tobto. za duhovite umove tse ridina. Oštar miris i oni koji, kada ga izvadite, objašnjavaju zašto je kiselina koncentrisana u maloj količini svjetlosti, ili kada se zagrije, često propada.
Hemija snage kiseline
Vchitel. Pogodite koje fraze razmjenjuju kiseline?(Naučni naziv.)
Prije nego što počnete s reagensima, prorokujte listu reakcija i zapišite svoje upozorenje (reakcije zapisivanja zahtjeva na TED svjetlu).
A sada se hranimo specifičnim moćima dušične kiseline.
Bili smo polirani, ali kiselina u slučaju zberganní zhovtíê, sada provodimo hemijsku reakciju:
4HNO 3 = 2H 2 O + 4NO 2 + O 2.
(Naučno za samostalno snimanje elektronske ravnoteže reakcije.)
"buri gas"(NE 2) farbu acid.
Kiselina se posebno redukuje u metale. Znate da su bacali vodu zbog kiselih razgradnji, ali to se ne dešava tokom interakcije sa azotnom kiselinom.
Zadivite se dijagramu koji imate na zabavi, prikazano je kako se vide gasovi tokom reakcije kiseline i koncentracije sa metalima.(Robot sa dijagramom.)
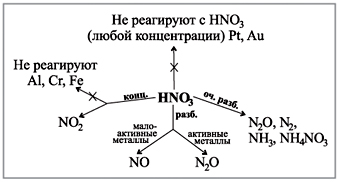
Demonstracija informacija:
interakcija koncentrirane dušične kiseline sa middy
Još efikasnija je demonstracija reakcije azotne kiseline (konc.) sa prahom medijuma ili dijeljenjem strelicom:
Naučno za samostalno snimanje elektronske ravnoteže reakcije:
Opsesija kiselinom
Vchitel. Lekcija će biti neshvatljiva, jer se ishrana dušične kiseline ne vidi.
Laboratorijska metoda: diya koncentrovane hlorovodonične kiseline na nitratu (slika 5).
NaNO3 + H2SO4 = NaHSO4 + HNO3.
At promislovostí kiselina u bazičnom posedu na amic način.
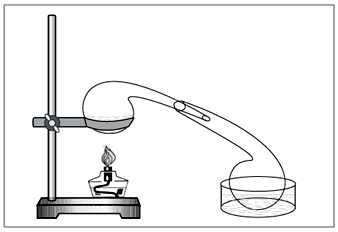
Mala. 5. Za uklanjanje azotne kiseline u laboratoriji
ručno birana vikoristovuvati staromodna hemijska jela - retorta
Metoda održavanja kiseline dušikom i kiselinom na temperaturama do 2000°C (električni luk) je posebno proširena bez skidanja.
U Rusiji i istoriji uklanjanja azotne kiseline to je bilo povezano sa imenima hemičara-tehnologa Ivana Ivanoviča Andreeva (1880-1919).
Vin u 1915. str. Otvarajući prvu instalaciju za acidifikaciju amonijakom i realizujući metode dezintegracije u fabričkim razmerama 1917. str. Prva fabrika nalazi se u Donjecku.
Cijela metoda uključuje nekoliko koraka.
1) Priprema samita o američkoj hrani.
2) Oksidacija amiaku kiselog povitrya na platinastim cittsi:
4NH 3 + 5O 2 = 4NO + 6H 2 O.
3) Dalje oksidira u dušikov oksid (II) u dušikov oksid (IV):
2NO + O2 = 2NO2.
4) Određivanje dušikovog (IV) oksida iz vode i sadržaja kiseline:
3NO2 + H2O = 2HNO3 + NO.
Lako je izvesti proces u prisustvu kiseline, sav dušikov (IV) oksid se pretvara u dušičnu kiselinu.
5) Zaključci faze uklanjanja azotne kiseline – prečišćavanje gasova, kao što je atmosfera, kao azotnih oksida. Skladište cich gasova: do 98% azota, 2-5% kiselina i 0,02-0,15% azotnih oksida. (Azot se uzima iz količine kiseline koja se koristi za oksidaciju amonijaka.) Ako je dušikovih oksida u ovim plinovima više od 0,02%, onda se posebno provodi da se katalitički ažuriraju u dušik, tako da je tako malo velikih problema .
Napisano od svih navedenih posta ishrane: a šta će nam kiselina?
Sisanje kiseline
Vchitel.Dušična kiselina je opasna za virobniting: azot je dobar, a na prvom mestu so aminske kiseline (kako postati opsednut?); vibuhovski govori (zašto?); barvnikiv; nítratív, o tome kako biti na ofanzivnom nivou.
Zatvaranje materijala
Frontalno iskustvo za razred
- Zašto je nivo oksidovanog azota u azotnoj kiselini +5, a valencija čotirija?
- Ne ulazi li dušična kiselina u reakciju sa svijetlim metalima?
- Treba znati hlorovodoničnu kiselinu i azotnu kiselinu, na stolu su tri metala - med, aluminijum i cink. Šta kažeš na šta?
Test
Opcija 1
1. Koji broj brojeva je povezan s raspodjelom elektrona za nivoe energije u atomu dušika?
1) 2, 8, 1; 2) 2, 8, 2; 3) 2, 4; 4) 2, 5.
2. Završite praktičnost praktičnih reakcija:
1) HNO 3 (ružičasta) + Cu ...;
2) Zn + HNO 3 (konc.) ...;
3) HNO 3 + MgCO 3 ...;
4) CuO + KNO 3….
3. Uvesti, po pravilu, jednu od faza procesa obećanja azotne kiseline.
1) 4NH 3 + 5O 2 = 4NO + 6H 2 O;
2) 5HNO 3 + 3P + 2H 2 O = 3H 3 PO 4 + 5NO;
3) N 2 + O 2 = 2NO.
4. Negativni koraci oksidacije manifestuju se dušikom na dnu:
1) N 2 O; 2) NE; 3) NE 2; 4) Na 3 N.
5. Interakcija strugotina meda s koncentriranom dušičnom kiselinom treba se proizvoditi dok se ne odobri:
1) NE 2; 2) NE; 3) N 2; 4) NH 3.
Opcija 2
1. Valentna vrijednost dušika je jedna:
1) 1; 2) 2; 3) 5; 4) 4.
2. Zapišite moguću interakciju koncentrovane azotne kiseline sa napredujućim metalima: natrijum, aluminijum, cink, zalizo, hrom.
3. Vibrirajući govor, poput ê syruvinoy za dušičnu kiselinu:
1) azot i voda;
2) amíak, ponekad ta voda;
3) nitrat.
4. Koncentrirana dušična kiselina ne reagira sa:
1) gas ugljen dioksida;
2) hlorovodonična kiselina;
3) u uglju;
4) hidroksidna šipka.
5. Uz interakciju razrijeđene kiseline i magnezija, treba uspostaviti sljedeće:
1) NE 2; 2) NE; 3) N 2 O; 4) NH 4 NO 3.
Izjave Opcija 1. 1 – 4;
3 – 1; 4 – 4; 5 – 1. Opcija 2. 1 – 4;
3 – 2; 4 – 1; 5 – 4. |
Trivnevy zalik spinner 11 klasa
Tema: " METALI "
Forma lekcije: zalik
Tsil: preispitati poznavanje stipendija na temu: "Nemetali"; javne informacije o nadmoćne moći nemetali i spoluk; promovirati formulaciju znanja o nestandardnim i životnim situacijama, iz zamjenskih i diferenciranih preduzeća.
Zavdannya:
1. Revidirati javni domen i zatvoriti znanje studija o nemetalima i í̈kh spoluksima; uzeti razvoj sa tačke gledišta obmanjujuće logike i volodje hemije; prelazak sa formalno-logičkog prihvatanja materijala od strane onih na figurativno logično razmišljanje uz pomoć naprednih, izvodljivih i nestandardnih građevina.
2. Promovirajte savjete opreza, otkrivanje pomilovanja, oslobađanje štaba, pojavu mrlja, povremene činjenice, uspjeh vivchayutsya, logičnu pobjedu misli i robusnost visnovke; vchiti rozmirkovuvati, robiti pripuschennya, prognoza.
3. Prihvatite formulisanje glavnih vizuelnih ideja kroz kognitivnu aktivnost i kreativnu nezavisnost naučnika.
4. Vihovuvati vmínnya pratsyuvati samokontrolu od samokontrole. Pokažite veze onima koji žive u životima. Vihovuvati naučni svitoglyad na osnovu međusobnog povezivanja moći koje budu.
Rukovanje tim reagensima: epruvete, alkoholne lampe, epruvete, sirnici i raščine: ; ;
; ;
;
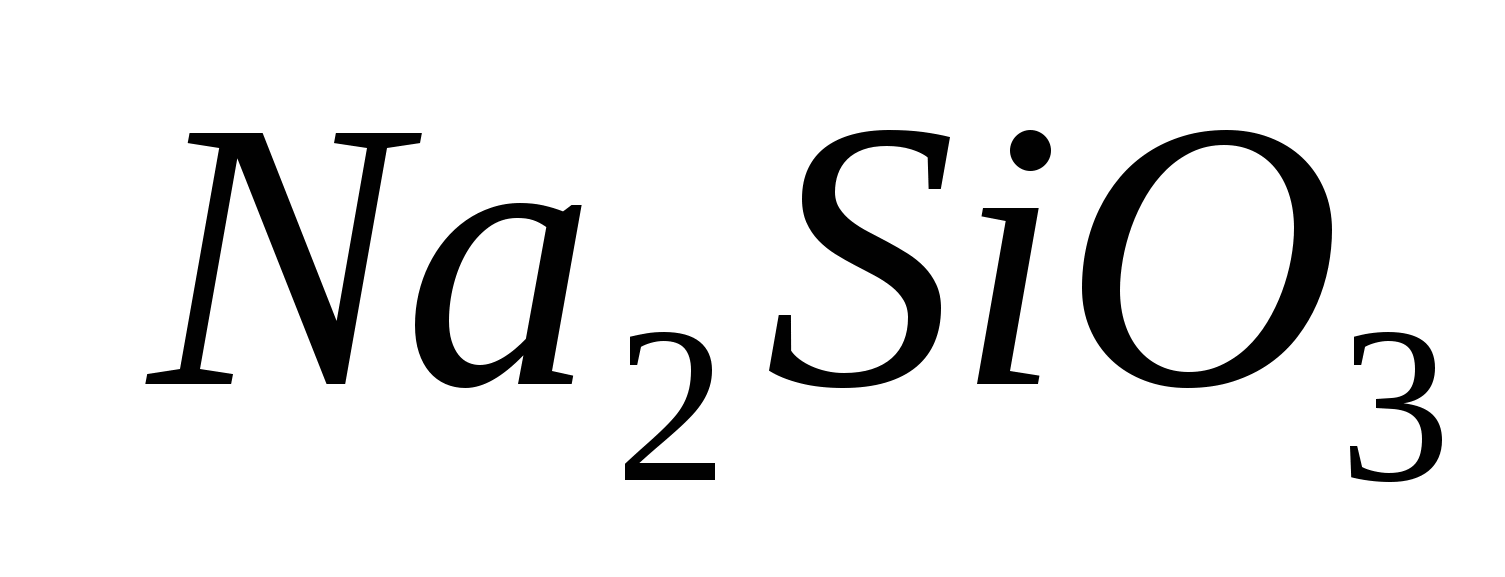 .
.
Priprema za ulazak.
Nastavnik je pripremio tri nivoa sklopivosti tipova početka: test, teorijska ishrana, razumevanje i razvoj reči.
Učitelj je spreman da vas edukuje, jer ćete revidirati tim.
Za 1 - 2 dana, informativni list se šalje u kancelariju.
List rute je vidljiv koži. Dijagram robota na stepenicama prikazan je na listovima rute.
ROUTE SHEET.
F.Í. učenjak
Imenujte korak
Raspored etapa
Matični broj
Poništavanje potpisa
Rozrakhunkov problem
Rosp_znavannya
Reinkarnacija
Idi na lekciju.
Naučnici ulaze u razred sa listovima rute, 5 praznih listova, sa olovkom i odlaze na binu, vrednosti za broj 1. Naučnici pokupe štap iza nabora i vraćaju se novom pisanju, ali spavaju, na bini od "označavanja riječi".
Na stupnju kože robota uvedeno je 7 - 8 čilija, koji pretvaraju vistavlju u tračni list rivn, br.
Procjena se prikazuje kao aritmetička sredina svih faza.
ADITIONER
"Prepoznavanje govora"
1 ríven
1. Uvjerite se da je Ion čist 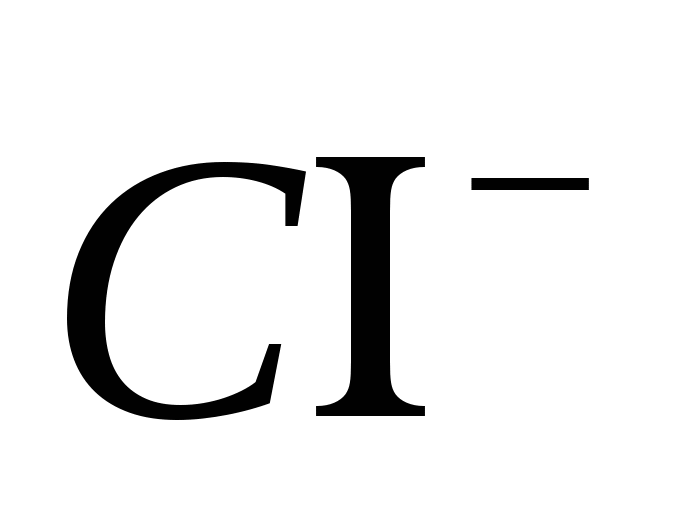
2. Uvjerite se da je Ion čist 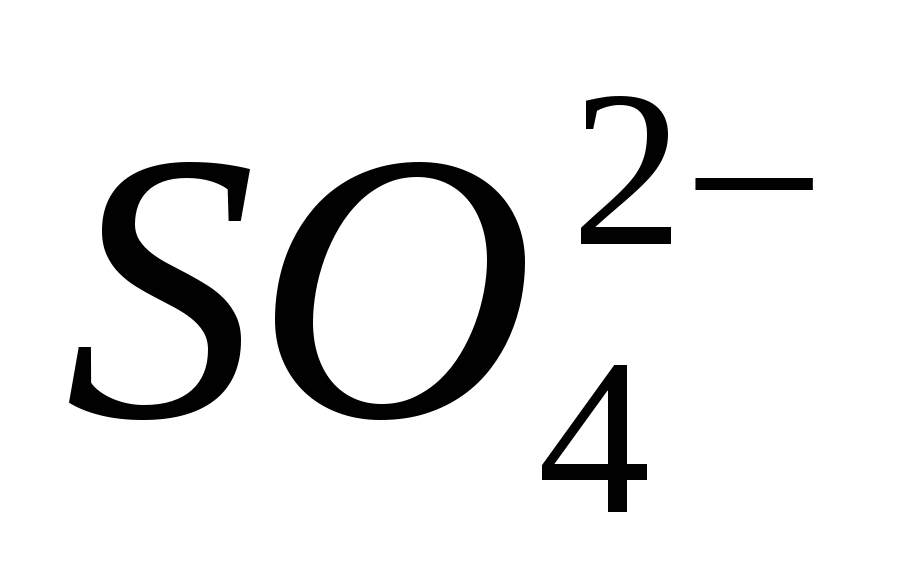
3. Uvjerite se da je Ion čist 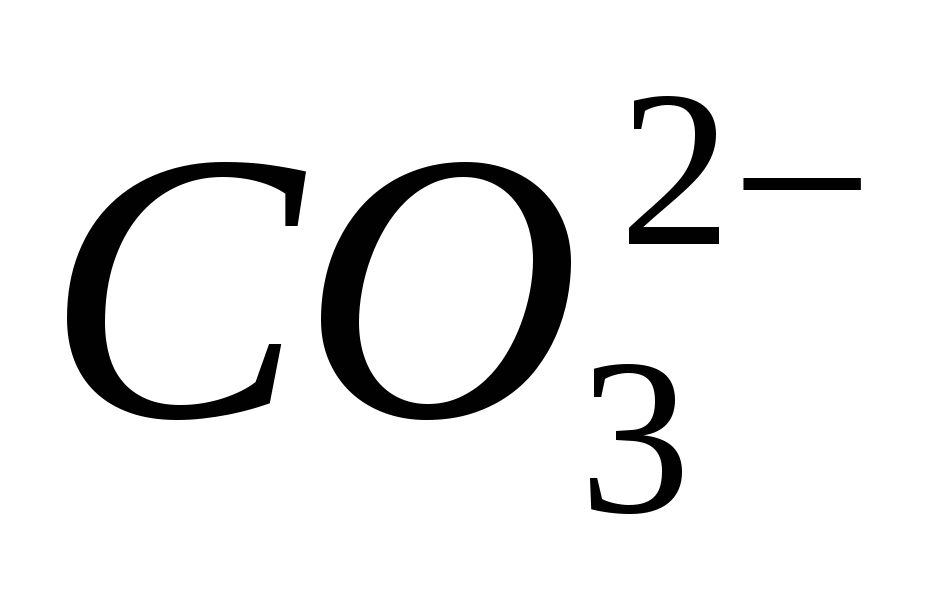
4. Uvjerite se da je Ion čist 
5. Donijeti identitet jona 
2 ríven
1. Otkrijte razlike iza jednog reagensa:
2. Odredite razlike iza jednog reagensa:
3. Odredite razlike iza jednog reagensa:
4. Odredite razlike iza jednog reagensa:  ;
;
5. Odredite razlike iza jednog reagensa:
3 ríven
1. Dizajn bez dodatnih reagensa za odobrenje:
2. Dizajn bez dodatnih reagensa za odobrenje:
3. Dizajn bez dodatnih reagensa za odobrenje:
4. Dizajn bez dodatnih reagensa za odobrenje:
5. Dizajn bez dodatnih reagensa za odobrenje:
Dodirnite "Revizija govora"
1 ríven
1. Završite standardne reakcije
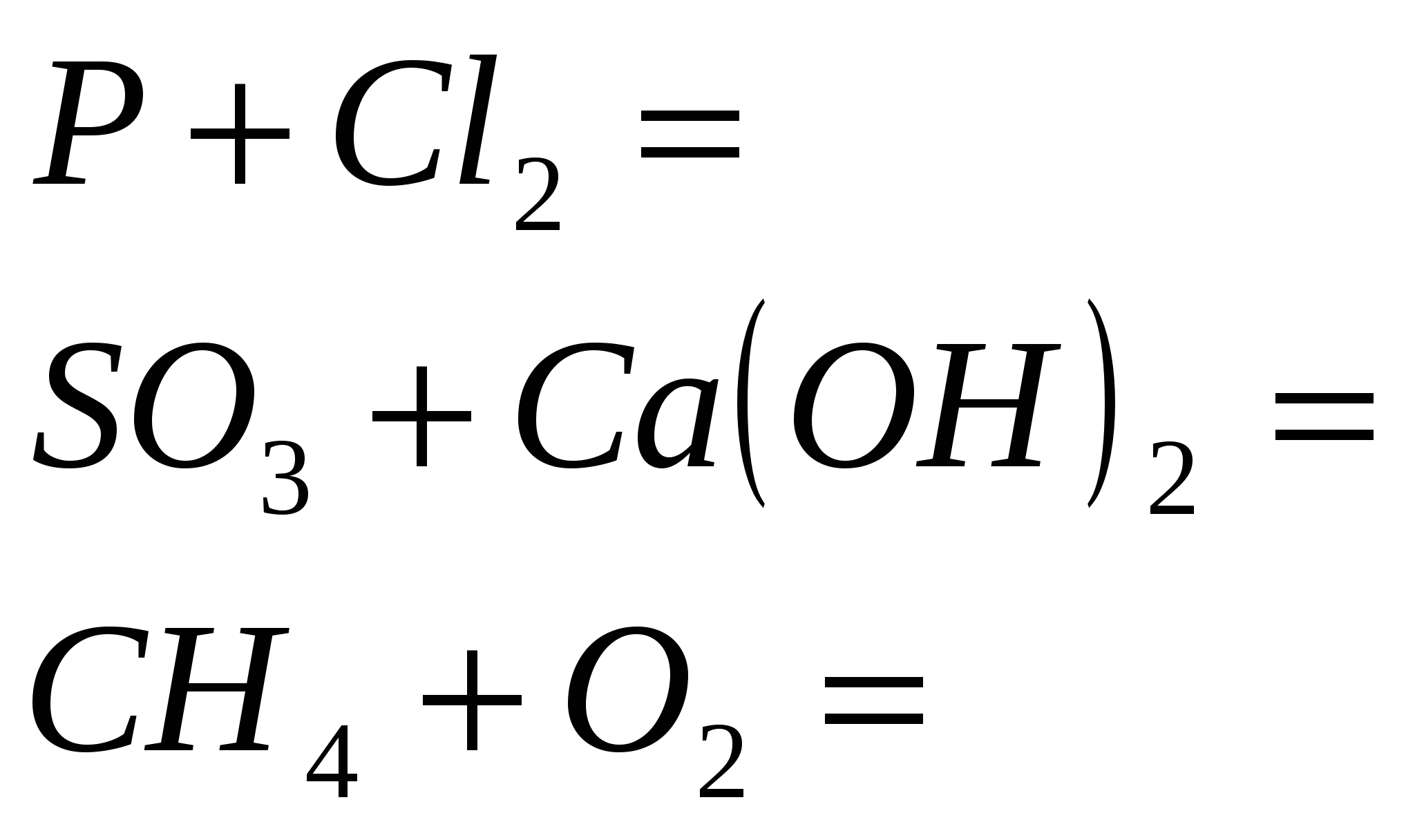
2. Za završetak rutinskih reakcija
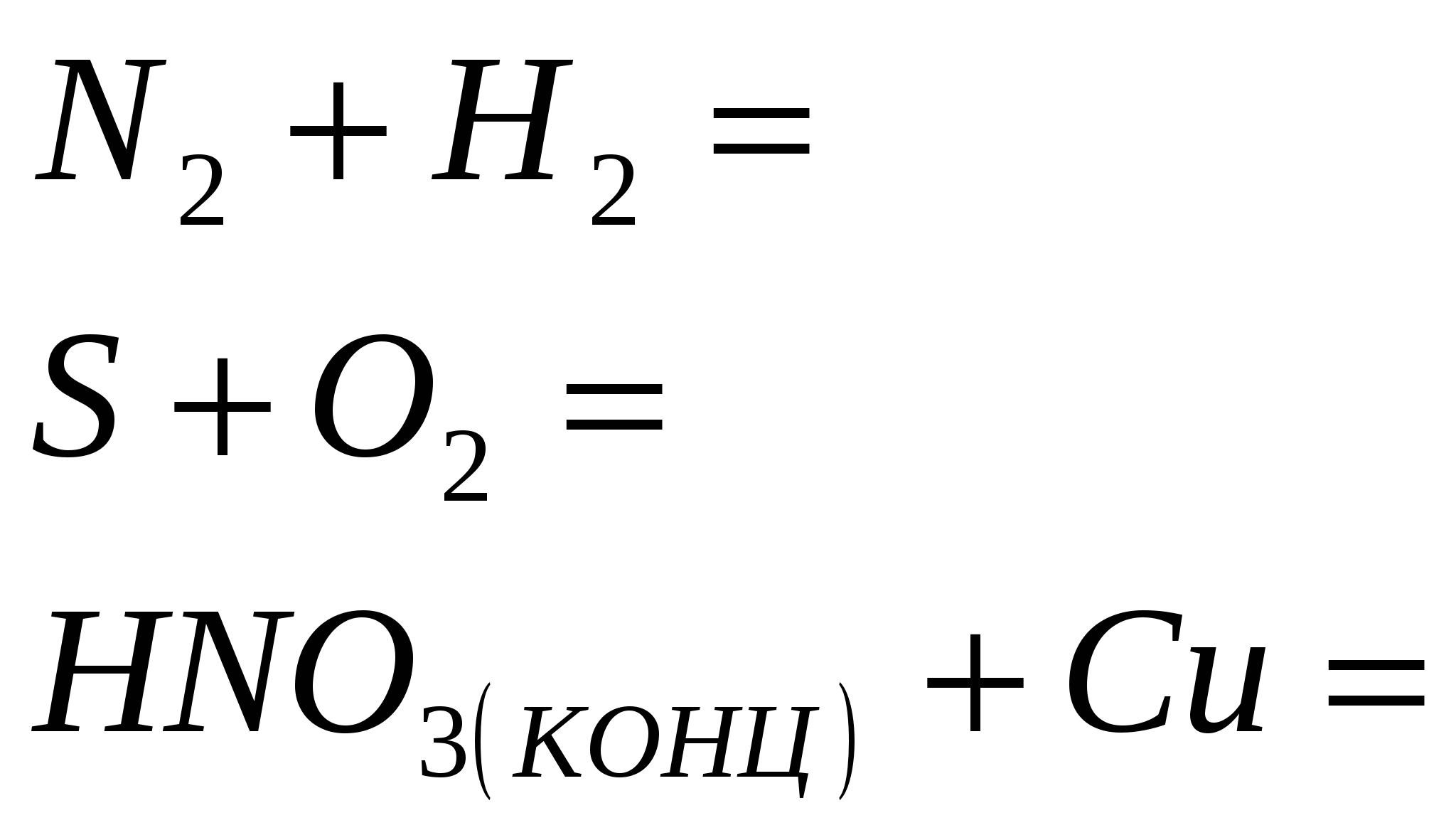
3. Za završetak rutinskih reakcija
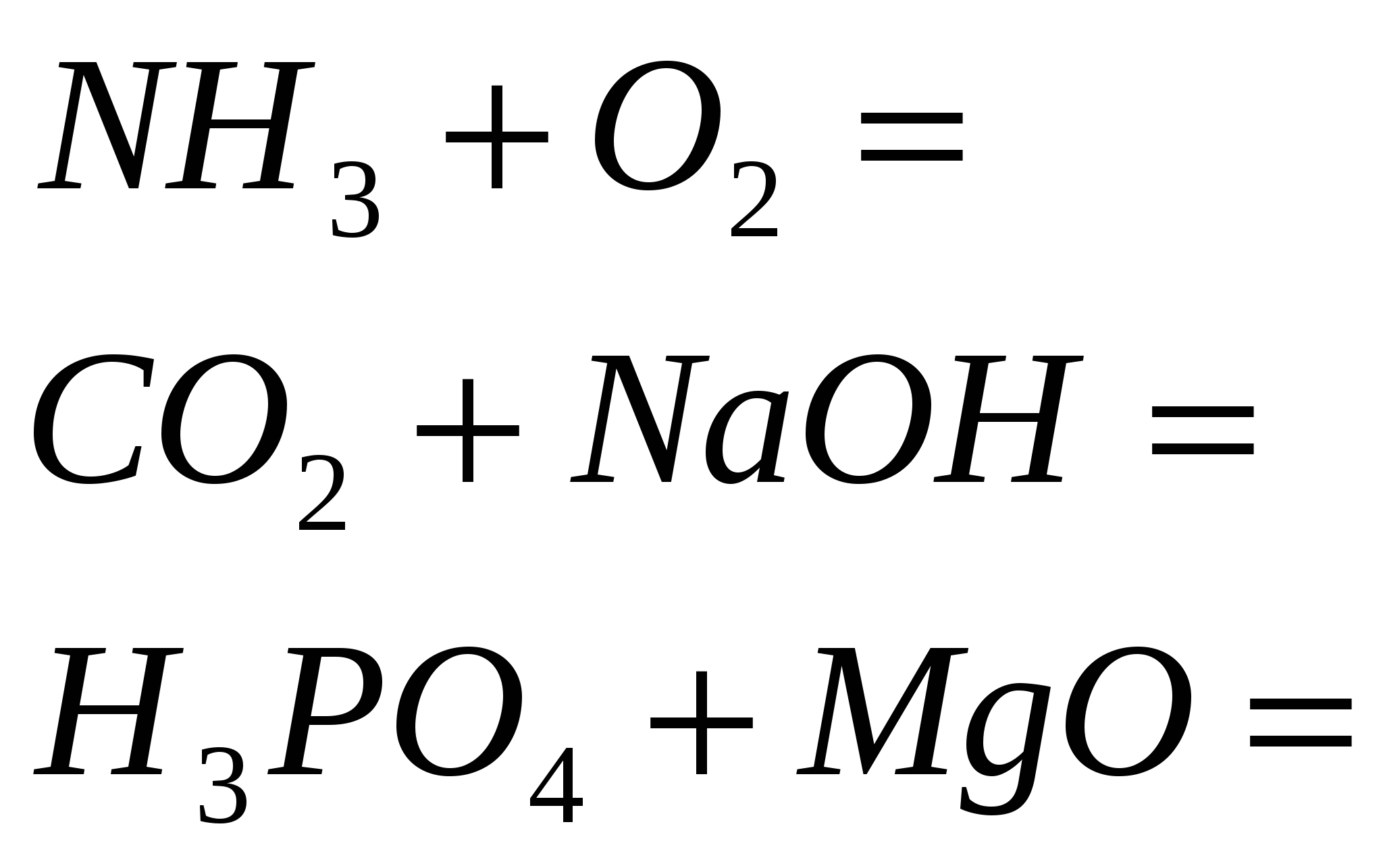
4. Završite rutinske reakcije
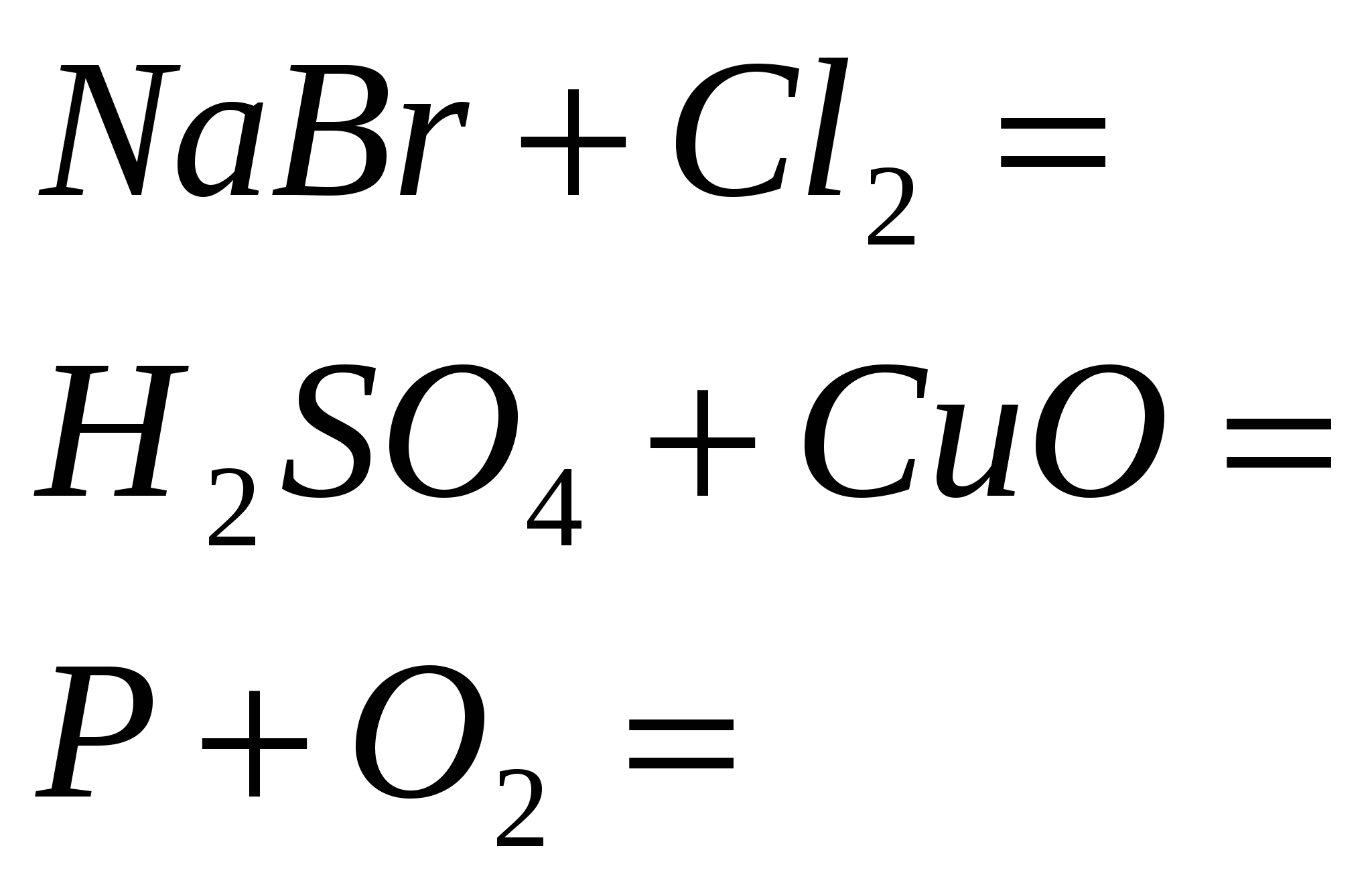
5. Završite rutinske reakcije
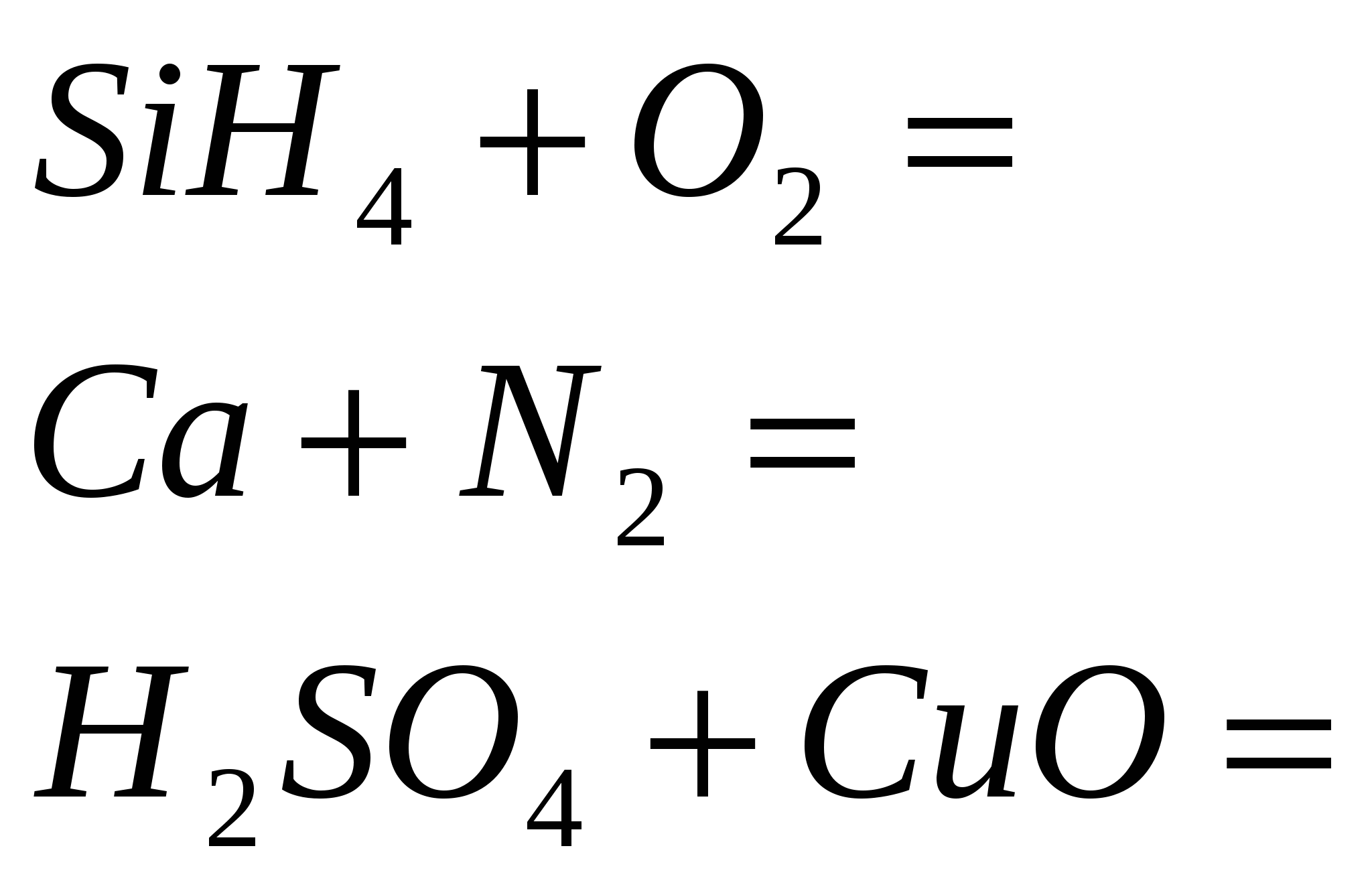
2 ríven
Zdíysnít revizija:
3ríven
Zdíysnít revizija:
3.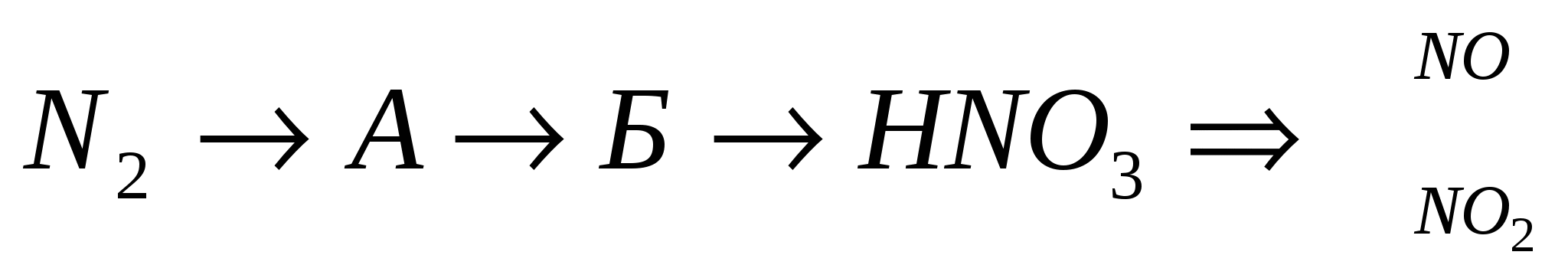
Korak "Test"
Opcija 1
a) O, b) S, c) Cl, d) C, e) Si.
a) 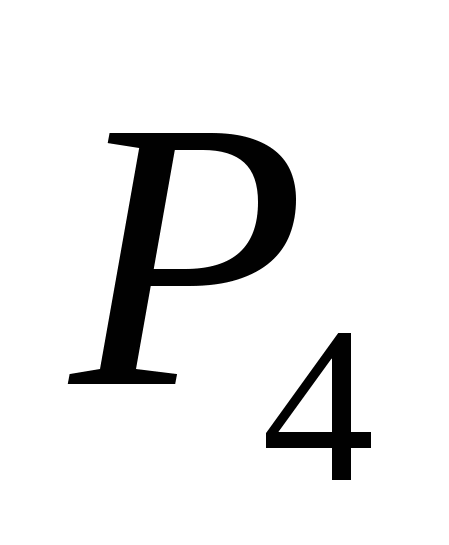 , b) C, c)
, b) C, c) 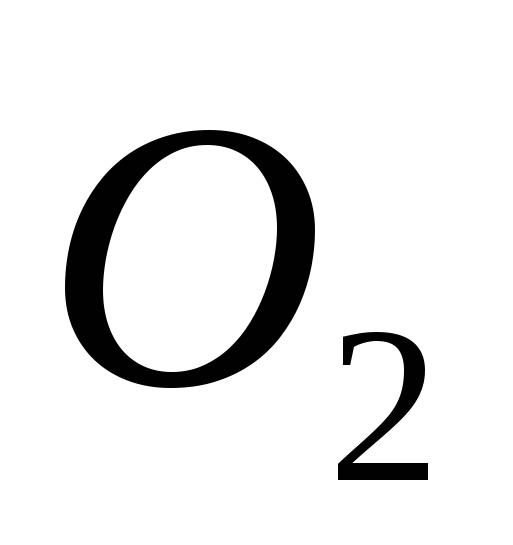 , G)
, G) 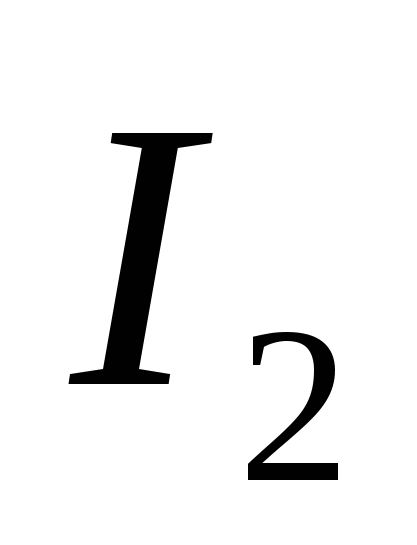 e)
e) 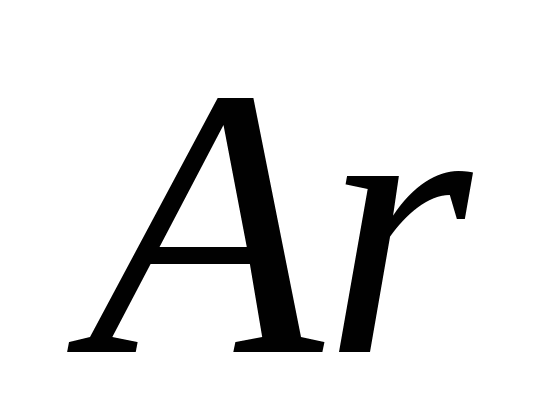 .
.
a)  , b)
, b) 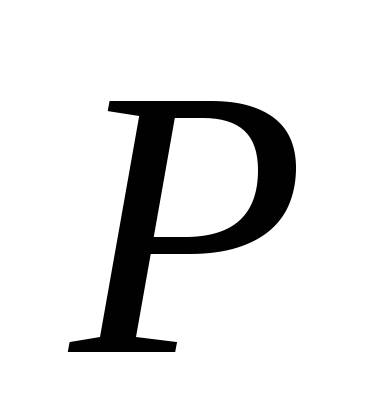 , v)
, v)  , G)
, G)  e)
e)  .
.
4. Elektronska formula elementa. Yogo flying vodena spoluk:
a)  , b)
, b)  , v)
, v)  , G)
, G)  .
.
5. Snaga rasta halogenovodoničnih kiselina u nizu:
a) ![]()
b) 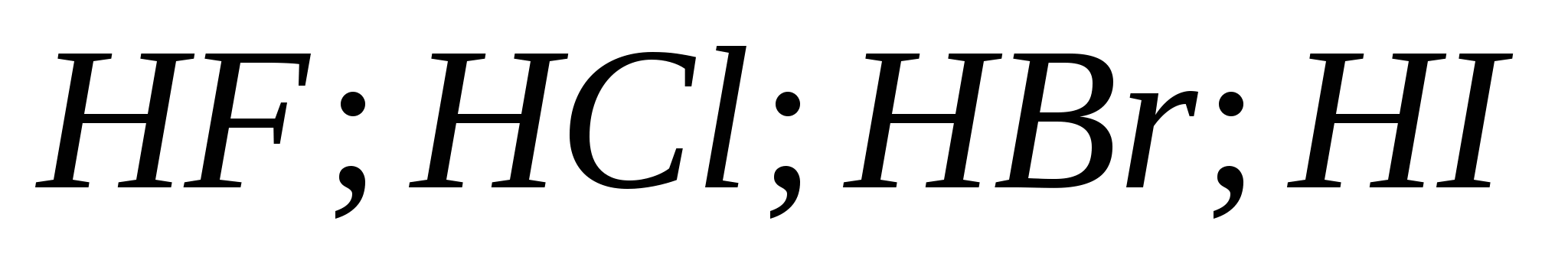
v) 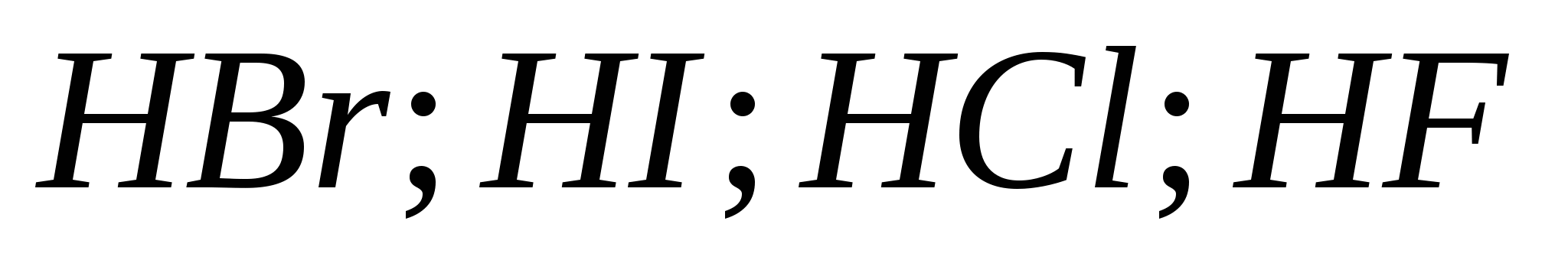
G) 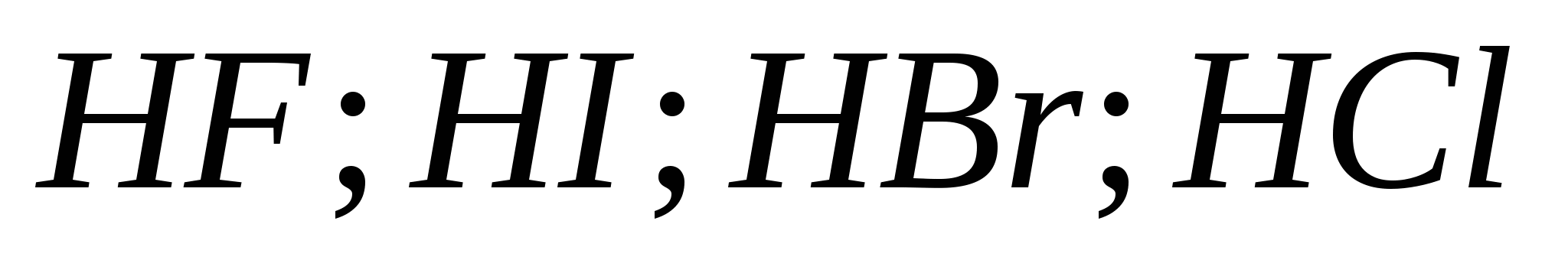
6. Od halogena ispred boyovyh diakha, govor je zapeo:
a) fluor; b) hlor; c) jod; d) brom.
7. Razrijeđena sirchan kiselina za oksidacionu moć za atome rakhunoka:
a)  , b)
, b)  , v)
, v)  .
.
8. Dušikov oksid V se može kombinovati:
a) 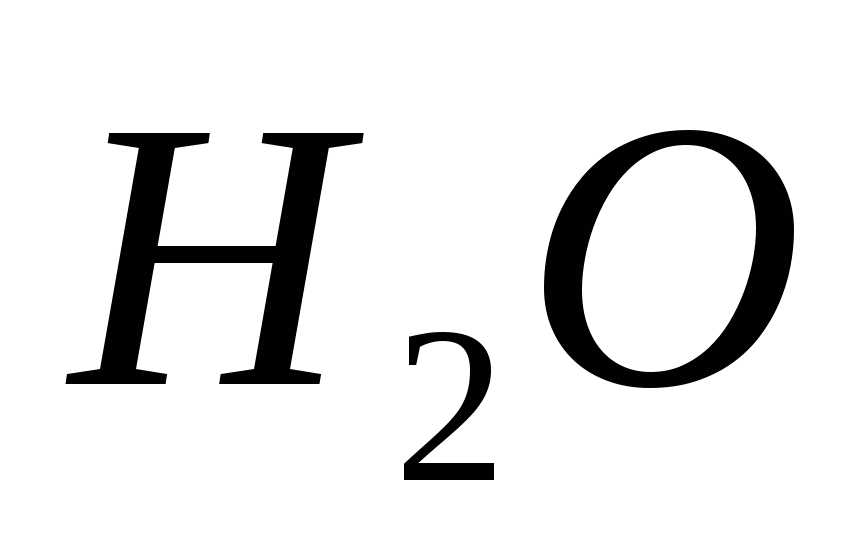 , b)
, b) 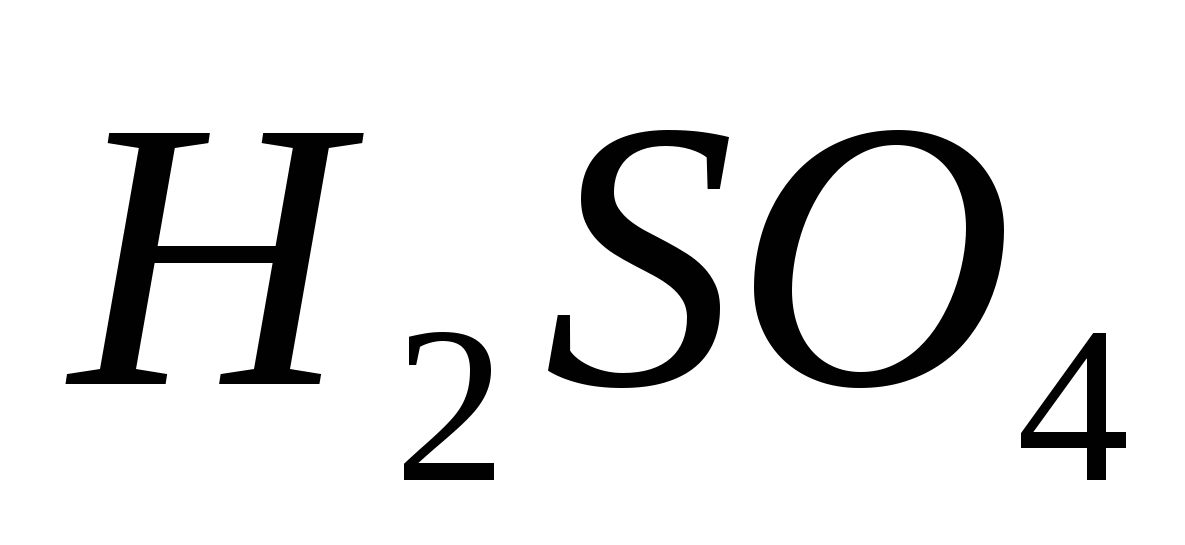 , v)
, v)  , G)
, G) 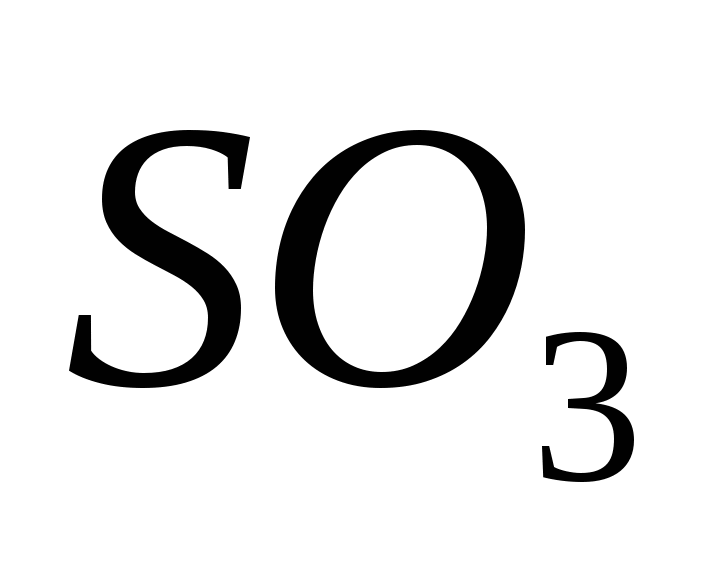 e)
e)  .
.
9. Reakcija: dovesti takve vlasti u Ameriku:
a) oksidativno, b) jednostruko, c) kiselo, d) bazično.
10. Jačina kiselina u nizu
a) promijeniti, b) rasti, c) promijeniti mnogo, zatim promijeniti; d) pad pada, rast rasta, e) ne mijenjaju se.
Opcija 2
Atomske kristalne rešetke mogu biti jednostavni govori, odobreni:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
2. Gas za normalne umove je:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
3. Alotropske modifikacije postavljaju sljedeće elemente:
a)  , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  ,
,
4. Elektronska formula elementa. Yogo flying vodena spoluk:
a) 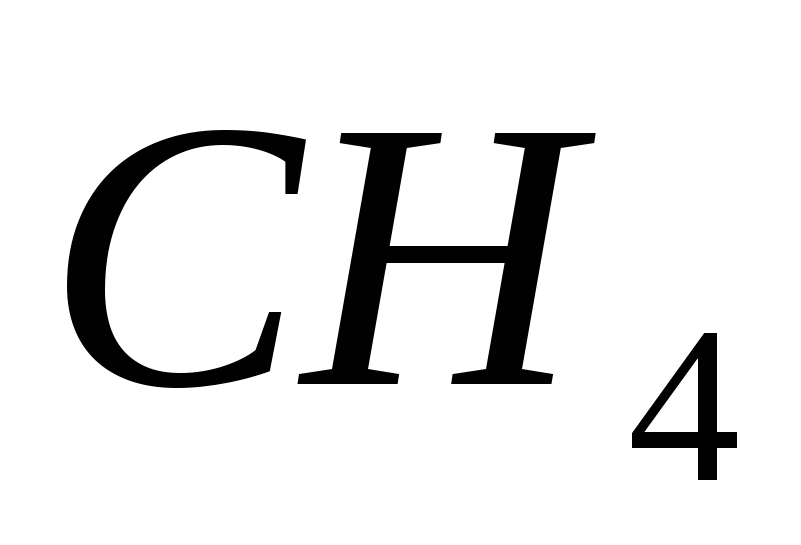 , b)
, b)  , v)
, v)  , G)
, G)  e)
e)  .
.
5. Glavna snaga ljetnih plovnih puteva mijenja se sljedećim redoslijedom:
a) 
b) 
v) 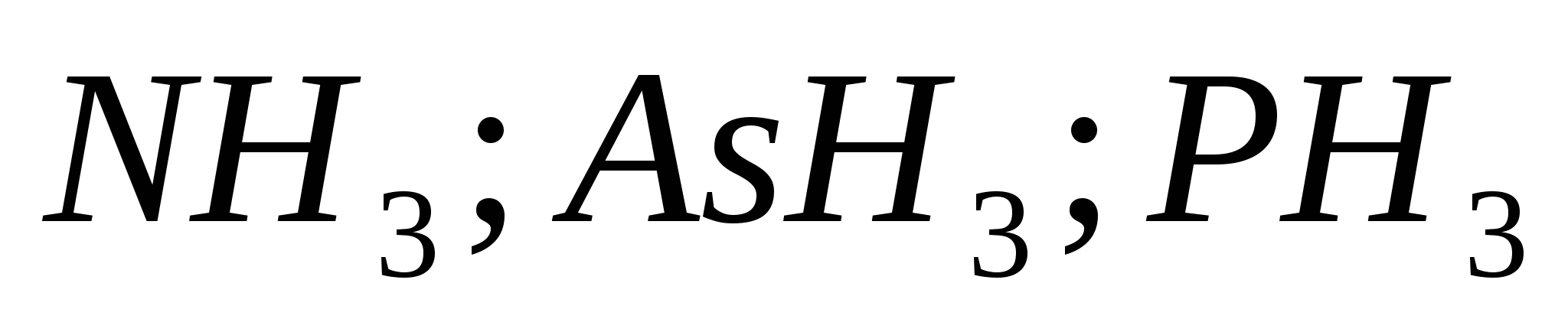
G) 
6. Za prianjanje na hlor možete odabrati korištenje koncentriranih otopina:
a)  , b)
, b) 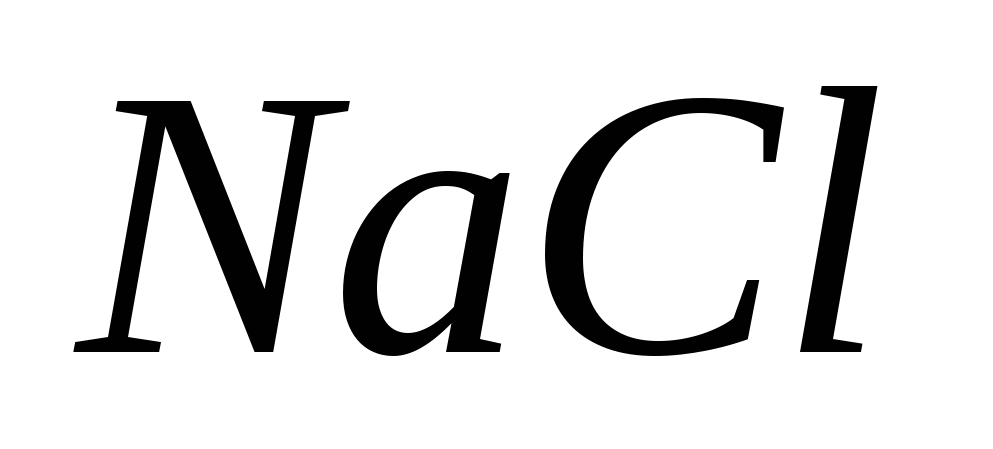 , v)
, v)  , G)
, G)  .
.
7. Koncentrirana sirchan kiselina je oksidirajuća moć za rakhunok atoma:
a)  , b)
, b)  , v)
, v)  .
.
NAPOMENA: 9-10 tačnih pogleda - "5"; 7-8- "4"; 5-6- "3"; manje od 5-2
Scena "Teorija"
ja ryven (do "3")
Zapišite tipične reakcije za karakterizaciju snage razrijeđene klorovodične kiseline.
Zapišite relevantne reakcije kako biste okarakterisali snagu serky oksida (VI).
Zapišite tipične reakcije kako biste okarakterizirali snagu natrijeve kiseline.
Zapišite relevantne reakcije kako biste okarakterisali snagu fosforovog (V) oksida.
Zapišite reakcije ryvnyannya, koje karakteriziraju moć Amerike.
ÍÍ ríven (do "4")
Zapišite formule nemetalnih ljetnih izvora vode u drugom periodu. Objasnite kako i zašto se mijenja snaga kiseline.
Zapišite formule za druge nemetalne okside u trećem periodu. Objasnite kako i zašto se mijenja snaga kiseline.
Zapišite formule najkiselih elemenata u III periodu. Objasnite kako i zašto se mijenja snaga kiseline.
Zapišite formule hlapljivih nemetala na bazi vode VI pidgrupe. Objasnite kako i zašto se mijenja snaga kiseline.
Zapišite formule najkiselih kiselina elemenata VA pid grupe. Objasnite kako i zašto dolazi do promjene snage kiseline.
III nivo (na "5")
Odredite kisela i kisela svojstva klorovodične i dušične kiseline. Molimo potvrdite jednostavne reakcije.
Odrediti oksidativnu i kiselinsku moć sivog oksida (IV) i oksida u ugljiku (IV). Molimo potvrdite direktnim reakcijama.
Podesite kiselost vode i vode sa fluorom. Molimo potvrdite jednostavne reakcije.
Odredite kiselost koncentrirane i razrijeđene dušične kiseline. Molimo potvrdite jednostavne reakcije.
Odredite kiselost oksida u ugljeniku (II) i oksida u ugljeniku (IV). Molimo potvrdite jednostavne reakcije.
Etap "Problem Rozrakhunkova"
ja ryven (do "3")
II ryven (na "4")
Uz interakciju 37 g kalcijum hidroksida sa amonijum sulfatom, uklanja se 15 g amonijaka. Izračunajte maseni dio ulaznog amiak%.
Kada je spaluvanní u kiselom, 62 g fosfornog buloa se obrušava sa 130 g fosfornog oksida (V). Izračunajte maseni udio ulaza u fosforov oksid (V)%.
Koliko grama od 10% vam je potrebno natrijum hidroksida da neutrališete 8,96 litara hlorne vode?
Filteri od litara ugljičnog dioksida mogu se urezati u pakovanja vapnjaka od 10 kg, tako da se može ukloniti 20% kućica.
Koliko grama opsade postaviti za prolazak 11,2 litara ugljičnog dioksida kroz 900 g šipke od 10% hidroksida?
III nivo (na "5")
Yaky obsyag 80% dušične kiseline (pl. 1,46 g / ml) potrebno za "razchinennya" 32 g meda?
Yaka masa će biti potrebna za reakciju s previše koncentriranom dušičnom kiselinom za uklanjanje 4 l (n.u.) dušikovog oksida (IV), koliki volumen ovog izlaza postaje 96%?
Pri „razbijanju“ u koncentraciji sirhanske kiseline 20 g legure zlata iz medijuma uočeno je 4,2 l (n.u.) oksida sirka (IV). Visnite maseni udio u % mase legure.
Količina gasa u hloru iu zapremini od 1 l propuštena je kroz rastvor jodidnog kalijuma. Vidio sam 5,08 r joda. Potražite frakciju (%) gasovitog hlora u opakoj sumi.
Količina silicijuma i vugile mase 10 g prelivena je preko previše koncentriranog raspona natrijum hidroksida. Kao rezultat reakcije, uočeno je 5,6 litara vode (n.a.). Visnite maseni udio silicija (%) na tsíy sumíshí.
