ऑक्सीजन के साथ सिलिकॉन के 28 ग्राम को जोड़ने पर। सिलिकॉन ऑक्सीजन यौगिक
सिलिकॉन। सामान्य विशेषता। कार्बन से मुख्य अंतर: यौगिकों में पी बॉन्ड की अनुपस्थिति। सिलिकोसिस। हाइड्रोजन (साइलेंस), ऑक्सीकरण और हाइड्रॉलिसिस के साथ यौगिक। टेट्रफ्लुओराइड और सिलिकॉन टेट्राक्लोराइड, हाइड्रोलाइसिस। हेक्साफ्लोरोसिलिकेट्स। ऑक्सीजन यौगिक। सिलिकॉन ऑक्साइड (IV)। अम्ल। सिलिकेट्स। घुलनशीलता और हाइड्रोलिसिस। प्राकृतिक सिलिकेट और एल्यूमिनोसिलिकेट्स, जिओलाइट्स। ऑर्गनोसिलिकॉन यौगिक। सिलिकोसिस और सिलोक्सनेस। दवा में सिलिकॉन यौगिकों का उपयोग।
सिलिकॉन (lat। सिलिकियम), Si, आवधिक प्रणाली के समूह IV का रासायनिक तत्व; परमाणु संख्या 14, परमाणु द्रव्यमान 28.086। सिलिकॉन भी इलेक्ट्रॉनिक के sp3 संकरण का प्रदर्शन करता है
कक्षाओं। सिलिकॉन परमाणु की बाहरी इलेक्ट्रॉन परत पर वैलेंस 3 डी होते हैं-
ऑर्बिटल्स (Si: 3s23p23d0),
ऑक्सीजन के बाद सिलिकॉन क्रस्ट में सबसे आम तत्व है। एक मुक्त अवस्था में कार्बन के विपरीत, सिलिकॉन प्रकृति में नहीं पाया जाता है। इसके सबसे आम यौगिक सिलिकॉन ऑक्साइड (IV) SiO2 और सिलिकिक एसिड लवण, सिलिकेट हैं। वे पृथ्वी की पपड़ी के खोल का निर्माण करते हैं। सिलिकॉन यौगिक पौधों और जानवरों में पाए जाते हैं। रासायनिक गुणों के अनुसार, सिलिकॉन, कार्बन की तरह, एक गैर-धातु है, लेकिन इसकी गैर-धातुता कम स्पष्ट है, क्योंकि इसमें एक बड़ा परमाणु त्रिज्या है
सिलिकॉन। लगभग सभी धातुओं के साथ यौगिक बनाता है - के साथ ilitsidy (केवल बी, टीएल, पीबी, एचजी के साथ यौगिक नहीं मिला)। 250 से अधिक सिलिकाइड प्राप्त किए गए थे, जिनकी रचना (MeSi, MeSi2, Me5Si3, Me3Si, Me2Si, आदि) आमतौर पर शास्त्रीय मान्यताओं के अनुरूप नहीं है। सिलिकोसिस में भिन्नता और कठोरता में अंतर होता है; फेरोसिलिकॉन (विशेष मिश्र धातुओं को गलाने में एजेंट को कम करना, फेरोएलोइज़ देखें) और मोलिब्डेनम साइलिसाइड MoSi2 (बिजली की भट्टियों के हीटर, गैस टरबाइन ब्लेड, आदि) सबसे बड़ा महत्वपूर्ण महत्व है।
Silane। सिलिकाइड पर हाइड्रोक्लोरिक एसिड की कार्रवाई के तहत, सिलिकॉन का सबसे सरल हाइड्रोजन यौगिक साइहेन SiH4 है:
सिलन एक जहरीली गैस है जिसमें एक अप्रिय गंध होता है जो अनायास निकलता है। हवा
वे प्रतिक्रियाशील हैं और मजबूत कम करने वाले एजेंट हैं।
कमरे के तापमान पर पानी के साथ प्रतिक्रिया करें:
SiH4 + 2H2O → SiO2 + 4H2:
tetrafluoride सिलिकॉन का निर्माण मौलिक फ्लोरीन के साथ सिलिकॉन डाइऑक्साइड के फ्लोरिनेशन द्वारा किया जाता है।
फ्लोरीनेशन की प्रक्रिया को एक लौ रिएक्टर में दो चरणों में किया जाता है, जिसमें प्रथम चरण से द्वितीय चरण तक मौलिक फ्लोरीन की अधिकता होती है।
तकनीकी परिणाम उच्च उपज और उत्पाद की गुणवत्ता के साथ निरंतर मोड में सिलिकॉन का उत्पादन है।
सिलिकॉन टेट्रफ्लुओराइड SiF4 का निर्माण ग्लास पर हाइड्रोफ्लोरिक (हाइड्रोफ्लोरिक) एसिड की क्रिया से होता है:
Na2SiO3 + 6HF® 2NaF + SiF4 + 3H2O
सिलिकॉन ऑक्सीजन यौगिक
सिलिकॉन का सबसे महत्वपूर्ण ऑक्सीजन यौगिक सिलिकॉन डाइऑक्साइड SiO2 (सिलिका) है, जिसमें कई क्रिस्टलीय संशोधन हैं।
निम्न-तापमान संशोधन (1143 K तक) को क्वार्ट्ज कहा जाता है। क्वार्ट्ज में पीजोइलेक्ट्रिक गुण हैं। क्वार्ट्ज की प्राकृतिक किस्में: रॉक क्रिस्टल, पुखराज, नीलम। सिलिका की किस्में शैलेडोनी, ओपल, एगेट, फ्री हैं। जैस्पर, रेत।
सिलिका रासायनिक रूप से प्रतिरोधी है; यह केवल फ्लोरीन, हाइड्रोफ्लोरोइक एसिड और क्षार के घोल से प्रभावित होता है। यह आसानी से कांच की अवस्था (क्वार्ट्ज ग्लास) में चला जाता है। क्वार्ट्ज ग्लास भंगुर, बहुत रासायनिक और थर्मल प्रतिरोधी है। इसी SiO2 सिलिकिक एसिड में एक विशिष्ट रचना नहीं होती है। आमतौर पर, सिलिकिक एसिड को xH2O-ySiO2 के रूप में दर्ज किया जाता है। सिलिकिक एसिड का चयन किया गया: H2SiO3 (H2O-SiO2) - मेटा-सिलिकॉन (तीन-ऑक्सो-सिलिकॉन), H4Si04 (2H20-Si02) - ऑर्थो-सिलिकॉन (टेट्रा-ऑक्सो-सिलिकॉन), H2Si2O5 (H2O * SiO2) - डाई-सिलिकॉन।
सिलिकिक एसिड खराब घुलनशील पदार्थ होते हैं। कार्बन की तुलना में सिलिकॉन की कम मेटालॉयड प्रकृति के अनुसार, इलेक्ट्रोलाइट के रूप में H2SiO3 H2CO3 से कमजोर है।
पानी में सिलिकिक एसिड लवण-सिलिकेट के अनुरूप अघुलनशील (क्षार धातु सिलिकेट को छोड़कर) हैं। घुलनशील सिलिकेट समीकरण द्वारा हाइड्रोलाइज्ड होते हैं
2SiO3 - + H20 = Si2O52- + 20H-।
घुलनशील सिलिकेट्स के केंद्रित समाधानों को तरल ग्लास कहा जाता है। सोडियम और कैल्शियम की सामान्य विंडो ग्लास सिलिकेट में Na20-CaO-6Si02 की संरचना होती है। यह प्रतिक्रिया द्वारा प्राप्त किया जाता है
सिलिकेट्स की एक विस्तृत विविधता (अधिक सटीक रूप से, ऑक्सोसिलिकेट्स) ज्ञात है। ऑक्सीओसिलेट्स की संरचना में एक निश्चित नियमितता देखी जाती है: सभी में Si04 टेट्राहेड्रा होता है, जो एक ऑक्सीजन परमाणु के माध्यम से एक दूसरे से जुड़े होते हैं। टेट्राहेड्रा के सबसे आम संयोजन हैं (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), जो संरचनात्मक इकाइयों के रूप में, जंजीरों, रिबन, जाल और कंकाल (छवि 4) में जोड़ा जा सकता है।
सबसे महत्वपूर्ण प्राकृतिक सिलिकेट्स हैं, उदाहरण के लिए, तालक (3MgO * H20-4Si02) और एस्बेस्टोस (SmgO * H2O * SiO2)। SiO2 की तरह, ग्लासी (अनाकार) अवस्था सिलिकेट्स की विशेषता है। कांच के नियंत्रित क्रिस्टलीकरण के साथ, एक क्रिस्टलीय राज्य (सिटॉल) प्राप्त करना संभव है। सीताएँ बढ़ी हुई ताकत की विशेषता होती हैं।
सिलिकेट्स के अलावा, एलुमिनोसिलिकेट्स प्रकृति में व्यापक हैं। एलुमिनोसाइलेट्स - फ्रेम ऑक्सोसिलिकेट्स, जिसमें सिलिकॉन परमाणुओं का एक हिस्सा ट्रिकेंट अल द्वारा प्रतिस्थापित किया जाता है; जैसे Na12 [(Si, Al) 04] 12।
सिलिकिक एसिड के लिए, एक कोलाइडल राज्य की विशेषता है जब एसिड H2SiO3 के लवण तुरंत प्रभावित नहीं होते हैं। कुछ शर्तों (उदाहरण के लिए, जब गर्म) के तहत सिलिकिक एसिड (सोल) के कोलाइडल समाधान को एक पारदर्शी, सजातीय जेल जैसे द्रव्यमान-जेल में सिलिकिक एसिड में बदला जा सकता है। जैल उच्च-आणविक यौगिक होते हैं जिनमें एसआईओ 2 अणुओं द्वारा गठित एक स्थानिक, बहुत ढीली संरचना होती है, जिनमें से v2 H2O अणुओं से भरे होते हैं। जब निर्जलित सिलिका जेल, सिलिका जेल प्राप्त होता है - उच्च सोखना क्षमता वाला एक झरझरा उत्पाद।
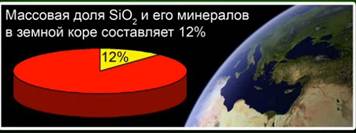
सिलिकॉन ऑक्साइड (IV) (सिलिका) - पृथ्वी की पपड़ी में सबसे आम यौगिक, विभिन्न खनिजों के रूप में अपने द्रव्यमान का 12% बनाता है। क्रिस्टलीय और अनाकार सिलिका के बीच भेद। सिलिकॉन ऑक्साइड (IV) का सरलतम सूत्र SiO2 है। यह परमाणु जाली में क्रिस्टलीकृत होता है।
1) क्रिस्टलीय सिलिका - क्वार्ट्ज और इसकी किस्मों के एक खनिज के रूप में (रॉक क्रिस्टल, चेल्डोनी, एगेट, जैस्पर, फ्लिंट); क्वार्ट्ज निर्माण और सिलिकेट उद्योग में व्यापक रूप से उपयोग किए जाने वाले क्वार्ट्ज रेत का आधार बनता है।
2) अनाकार सिलिका - ओपल खनिज संरचना SiO2 nH2O के रूप में; अनाकार सिलिका के मिट्टी के रूप डायटोमाइट, त्रिपोली (इन्फ्यूसोरियल अर्थ) हैं; कृत्रिम अनाकार निर्जल सिलिका का एक उदाहरण सिलिका जेल है, जो सोडियम मेटासिलिकेट से प्राप्त होता है:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
सिलिका जेल की एक विकसित सतह होती है यही कारण है कि यह नमी को अच्छी तरह से अवशोषित करता है।
सिलिका जेल पीएच\u003e 5-6 पर सिलिकिक एसिड (nSiO2 · mH2O) के सुपरसैचुरेटेड समाधानों से बनने वाला एक सूखा जेल है। ठोस हाइड्रोफिलिक शर्बत।
स्वागत
यह क्षार धातु सिलिकेट समाधानों के अम्लीकरण द्वारा प्राप्त होता है, इसके बाद बने जेल को धोकर और सुखाकर:
सिलिकिक एसिड। SiO2 सिलिकिक एसिड की एक संख्या का एनहाइड्राइड है
सिलिकिक एसिड टेट्राहेड्रल संरचनात्मक इकाइयों (ऐसी प्रत्येक इकाई में, सिलिकॉन परमाणु टेट्राहेड्रोन के केंद्र में है, और ऑक्सीजन परमाणु सबसे ऊपर स्थित हैं) से बना है। संरचनात्मक लिंक, जंजीरों में एकजुट होकर, अधिक स्थिर पॉलीसिलिकॉन एसिड बनाते हैं:
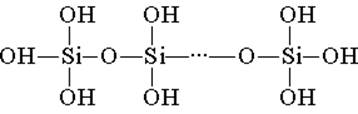
इस तरह के एक यौगिक की संरचना सूत्र (H2SiO3) n द्वारा व्यक्त की जा सकती है। हालांकि, सिलिकिक एसिड को आमतौर पर सूत्र H2SiO3 द्वारा दर्शाया जाता है। H2SiO3 - एसिड बहुत कमजोर है, पानी में थोड़ा घुलनशील है। गर्म होने पर, यह कार्बोनिक एसिड के समान आसानी से विघटित हो जाता है:
सभी सिलिकिक एसिड बहुत कमजोर (कोयले की तुलना में कमजोर) होते हैं।
सिलिकेट। सभी सिलिकिक एसिड के लवण को सिलिकेट्स कहा जाता है, हालांकि, एक नियम के रूप में, शैक्षिक साहित्य में, मेथासिलिक एसिड के लवण को स्पष्ट करता है। उनकी रचना आमतौर पर तत्वों के ऑक्साइड के यौगिकों के रूप में सूत्र द्वारा दर्शायी जाती है। उदाहरण के लिए, कैल्शियम सिलिकेट CaSiO3 के रूप में व्यक्त किया जा सकता है: CaO × SiO2।
संरचना R2O × nSiO2 के सिलिकेट्स, जहां R2O सोडियम या पोटेशियम ऑक्साइड होते हैं, घुलनशील ग्लास कहलाते हैं, और उनके केंद्रित जलीय घोलों को तरल ग्लास कहा जाता है। सबसे महत्वपूर्ण सोडियम घुलनशील ग्लास है।
जब हवा में खड़े होते हैं, सिलिकेट्स के घोल में वृद्धि होती है, क्योंकि हवा में कार्बन डाइऑक्साइड (IV) अपने लवण से सिलिकिक एसिड को विस्थापित करता है:
सिलिकिक एसिड पानी में व्यावहारिक रूप से अघुलनशील है - इस गुण का उपयोग आयन SiO32- के लिए एक गुणात्मक प्रतिक्रिया के रूप में किया जाता है।
सिलिकेट को अल्कली या कार्बोनेट के साथ सिलिका में मिला कर प्राप्त किया जाता है:
सिलिकिक एसिड घुलनशीलता और इसके विघटन की दर कई कारकों पर निर्भर करती है, जिनमें से सबसे महत्वपूर्ण सिलिकॉन डाइऑक्साइड के संशोधन, इसके फैलाव की डिग्री, और तापमान हैं। जब पानी के साथ सिलिका जेल मिलाते हैं, तो घुलनशीलता संतुलन कुछ घंटों में स्थापित हो जाता है, क्वार्ट्ज के मामले में, कई महीनों और यहां तक कि वर्षों की आवश्यकता होती है।
प्राकृतिक वैज्ञानिक (लैटिन से। सिलेक्स, जीनस। सिलिकोसिस का मामला। फ्लिंट * ए। प्राकृतिक सिलिकिक; एन। नाइट्रिचिलि सिलिकेट; एफ। नेचरल को सिलिकेट करता है; और सिलिकिकोस नेचुरल) - खनिजों का एक वर्ग, सिलिकिक, आइसो- और हेटेरोपायक्लिनिक एसिड का लवण। प्राकृतिक सिलिकेट्स की हिस्सेदारी पृथ्वी की पपड़ी के द्रव्यमान का 75% और खनिज प्रजातियों का लगभग 25% है। प्रकृति में, 700 से अधिक प्राकृतिक सिलिकेट्स को जाना जाता है, जिसमें सबसे महत्वपूर्ण रॉक-बनाने वाले खनिज (फेल्डस्पार, पायरोक्सेन, एम्फ़िबोल, माइका, आदि) शामिल हैं।
aluminosilicates - प्राकृतिक और सिंथेटिक सिलिकेट्स का एक समूह, जिसके जटिल आयनों में सिलिकॉन और एल्यूमीनियम होते हैं। जटिल आयनों के उदाहरण: -, -, 2 -। Na +, K +, Mg2 +, Ca2 +, और कभी-कभी Ba2 + और Li + कटियन के रूप में कार्य करते हैं।
प्राकृतिक एलुमिनोसाइलेट्स सबसे आम खनिज हैं, वे पृथ्वी की पपड़ी के द्रव्यमान का 50% तक खाते हैं। इनमें फेल्डस्पार (अल्बाइट, ऑर्थोक्लेज़, एओरोइट), मिट्टी के खनिज और अभ्रक शामिल हैं।
zeolites - ये कैल्शियम, सोडियम, पोटेशियम, बेरियम और कुछ अन्य तत्वों के जलीय aluminosilicates हैं। जिओलाइट्स के समूह में चालीस से अधिक खनिज शामिल हैं, जो संरचना में भिन्न होते हैं (विशेषकर क्रिस्टलीय हाइड्रेट में पानी के अणुओं की संख्या में), और निश्चित रूप से भौतिक और रासायनिक गुणों में। लेकिन खनिजों के इस समूह के लगभग सभी प्रतिनिधियों में एक सामान्य विशेषता है - वे अच्छे शर्बत हैं, आयन-विनिमय गुणों के अधिकारी हैं, व्यक्तिगत आयनों की गतिशीलता को बदलने और आणविक सिस्टर्स के रूप में काम करने में सक्षम हैं। और अपेक्षाकृत हाल ही में, इन खनिजों ने एक पूरी तरह से अप्रत्याशित उपयोग पाया है - वे कृषि में इस्तेमाल होने लगे।
ऑर्गोसिलिकॉन यौगिक - ऐसे यौगिक जिनके अणुओं में सिलिकॉन और कार्बन परमाणुओं के बीच एक बंधन होता है। ऑर्गनोसिलिकॉन यौगिकों को कभी-कभी सिलिकोन कहा जाता है, लैटिन सिलिकॉन नाम "सिलिकॉन" से। ऑर्गेनोसिलिकॉन यौगिकों का उपयोग स्नेहक, पॉलिमर, घिसने वाले, घिसने वाले, सिलिकॉन तरल पदार्थ और इमल्शन के उत्पादन के लिए किया जाता है। ऑर्गेनोसिलिकॉन यौगिकों का उपयोग सौंदर्य प्रसाधन, घरेलू रसायनों, पेंट और वार्निश, डिटर्जेंट में किया जाता है। आम कार्बनिक यौगिकों पर आधारित उत्पादों से ऑर्गोसिलिकॉन यौगिकों पर आधारित उत्पादों की एक विशिष्ट विशेषता, एक नियम के रूप में, उच्च प्रदर्शन विशेषताओं और विशेषताओं, साथ ही साथ मानव उपयोग की सुरक्षा भी है। खाना पकाने में मोल्ड बनाने के लिए सिलिकॉन पॉलिमर का उपयोग किया जा सकता है। ऑर्गेनोसिलिकॉन यौगिकों और सीलेंट का पॉलिमराइजेशन मनुष्यों के लिए सुरक्षित है और उन्हें निष्कर्षण की आवश्यकता नहीं है।
siloxane - एक अणु में वैकल्पिक सिलिकॉन और ऑक्सीजन परमाणुओं वाले यौगिक। उच्चतम में उच्च आणविक भार सिलोकेन हैं - पॉलीऑर्गोनोसिलॉक्सन; सिलिकॉन पॉलिमर देखें।
सिलिकॉन (पॉलीऑर्गेनोसिलॉक्सन्स) - रासायनिक सूत्र n के साथ ऑक्सीजन युक्त उच्च आणविक भार ऑर्गोसिलिकॉन यौगिक, जहां आर = कार्बनिक समूह (मिथाइल, एथिल या फिनाइल)। अब यह परिभाषा शायद ही कभी पालन की जाती है, और पॉलीगोनोसिलोक्सेन (उदाहरण के लिए, पीएमएस प्रकार के सिलिकॉन तेल, एनजीएल प्रकार के पानी के रिपेलेंट्स या कम आणविक भार SKTN घिसने वाले) और यहां तक कि ऑर्गोसिलिकॉन मोनोमर्स (विभिन्न साइलेंस) को भी "सिलिकॉन्स" में जोड़ा जाता है, जो "सिलिकॉन्स" के बीच के अंतर को मिटा देता है। " सिलिकॉन
धात्विक सिलिकॉन  क्रिस्टल सिलिकॉन
क्रिस्टल सिलिकॉन
सिलिकॉन (Si)। यह रासायनिक तत्व पृथ्वी की पपड़ी की संरचना का 1/4 हिस्सा है। क्वार्ट्ज, रॉक क्रिस्टल, रेत, मिट्टी, ग्रेनाइट, अभ्रक, अभ्रक - यह सब सिलिकॉन के रासायनिक यौगिक
सिलिकॉन एक मध्यवर्ती तत्व (एम्फोटेरिक) है और यह धातु और गैर-धातु दोनों गुणों को प्रदर्शित कर सकता है। यह धातुओं और गैर-धातुओं दोनों के साथ रासायनिक यौगिकों का निर्माण कर सकता है।
शुद्ध सिलिकॉन - ग्रे रंग का एक रासायनिक रूप से सरल पदार्थ, कठोर, दुर्दम्य और भंगुर। क्रिस्टल सिलिकॉन इसमें एक धातु की चमक है और इसका व्यापक रूप से अर्धचालक उद्योग में उपयोग किया जाता है (यह एक अर्धचालक है)।
सिलिकॉन क्रिस्टलीय अवस्था की तरह फैल सकता है ( क्रिस्टलीय सिलिकॉन), और अनाकार अवस्था में ( अनाकार सिलिकॉन)। क्रिस्टलीय सिलिकॉन पिघले हुए धातु में अनाकार सिलिकॉन के घोल को ठंडा करके बनाया जाता है। बदले में, क्रिस्टलीय सिलिकॉन एक बहुत ही भंगुर सामग्री है और आसानी से एक अनाकार पाउडर में कुचल दिया जाता है। इस प्रकार, अनाकार सिलिकॉन क्रिस्टलीय सिलिकॉन के क्रिस्टल का एक टुकड़ा है।
मुक्त अवस्था में, सिलिकॉन प्राप्त करना काफी कठिन होता है। इसका औद्योगिक उत्पादन क्वार्ट्ज की रिकवरी से जुड़ा है, जिसका रासायनिक सूत्र SiO 2 है, कमी प्रतिक्रिया गर्म कोक (कार्बन) द्वारा निर्मित होती है।
SiO 2 + C → CO 2 + Si
प्रयोगशाला में, निम्न प्रतिक्रिया का उपयोग करके धातु मैग्नीशियम के साथ सिलिका रेत से शुद्ध सिलिकॉन को कम किया जाता है:
SiO 2 + 2Mg → Si + 2MgO।
इस प्रतिक्रिया के दौरान, अनाकार सिलिकॉन का एक भूरा पाउडर बनता है। जब गरम किया जाता है, तो पाउडर धीरे-धीरे क्षार के केंद्रित समाधान के साथ प्रतिक्रिया कर सकता है (उदाहरण के लिए, सोडियम हाइड्रॉक्साइड NaOH)
Si + 2NaOH + H 2 O → Na 2 SiO 3 + 2H 2, - जिसके परिणामस्वरूप जटिल पदार्थ - जिसे तरल ग्लास भी कहा जाता है।
यह दिलचस्प है कि सिलिकॉन की रासायनिक गतिविधि उसके क्रिस्टल के आकार पर निर्भर करती है। सह-क्रिस्टलीय सिलिकॉन अनाकार की तुलना में कम रासायनिक रूप से सक्रिय है। उत्तरार्द्ध साधारण तापमान पर भी आसानी से फ्लोरीन के साथ प्रतिक्रिया करता है, और 400 - 600 0 सी के तापमान पर यह ऑक्सीजन, क्लोरीन, ब्रोमीन, सल्फर के साथ प्रतिक्रिया करता है ताकि संबंधित रासायनिक यौगिक बन सकें। बहुत अधिक तापमान पर, सिलिकॉन नाइट्रोजन और कार्बन के साथ क्रमशः, नाइट्राइड और सिलिकॉन कार्बाइड के साथ प्रतिक्रिया करता है।
यदि आप हाइड्रोफ्लोरिक एचएफ (हाइड्रोफ्लोरिक) और नाइट्रिक एचएनओ 3 एसिड के मिश्रण में सिलिकॉन को भंग करने की कोशिश करते हैं, तो प्रतिक्रिया आगे नहीं बढ़ेगी। लेकिन यदि आप एक क्षार के साथ रासायनिक प्रतिक्रिया करते हैं, उदाहरण के लिए, पोटेशियम हाइड्रॉक्साइड के साथ, तो प्रतिक्रिया सिलिकिक एसिड के नमक के निर्माण के साथ होगी
Si + KOH → K 2 SiO 3 + H 2
यदि कोक के साथ भट्ठी सिलिका (रेत) में कैलक्लाइंड किया जाता है, तो यह एक बहुत ही ठोस क्रिस्टलीय पदार्थ निकलता है। कारबरंडम सिक
SiO 2 + 3C → SiC + 2CO
कारबरंडम - बहुत कठोर और दुर्दम्य पदार्थ। उद्योग में, इन गुणों के कारण बड़ी मात्रा में इसका उत्पादन किया जाता है। दिलचस्प है, कारबोरंडम क्रिस्टल जाली सबसे कठिन पदार्थ - हीरे के जाली के समान है, लेकिन इसमें व्यक्तिगत कार्बन परमाणुओं को सिलिकॉन परमाणुओं द्वारा समान रूप से प्रतिस्थापित किया जाता है।
उच्च तापमान पर, साथ ही सिलिकॉन के साथ धातु के यौगिकों पर एसिड की कार्रवाई के तहत रासायनिक प्रतिक्रियाओं के दौरान, silane सिह ४।
Cilan - यह एक आत्म-प्रज्वलित रंगहीन गैस है। यह सिलिका और पानी बनाने के लिए हवा में प्रज्वलित कर सकता है।
SiH 4 + 2O 2\u003e → SiO 2 + 2H 2 O
यदि क्लोरीन की एक धारा में कार्बन की उपस्थिति में सिलिकॉन ऑक्साइड SiO 2 को गर्म किया जाता है, तो सिलिकॉन क्लोराइड के निर्माण के साथ एक रासायनिक प्रतिक्रिया होती है
SiO 2 + 2C + 2 Cl 2 → SiCl 4 + 2CO
सिलिकॉन क्लोराइड - यह एक तरल पदार्थ है, जिसका उबलता तापमान केवल ५४ ० सी है। सिलिकॉन क्लोराइड दो अम्लों के घोल के साथ पानी में आसानी से घुल जाता है।
SiCl 4 + H 2 O → H 2 SiO 3 + HCl
यदि यह रासायनिक प्रतिक्रिया नम हवा के वातावरण में बढ़ती है, तो दो एसिड के गठन के दौरान मोटा धुआं दिखाई देगा।
सिलिकॉन फ्लोराइड SiF 4 - हाइड्रोफ्लोरिक एसिड और सिलिकॉन ऑक्साइड की रासायनिक प्रतिक्रिया के परिणामस्वरूप बनता है
SiO 2 + 4HF → SiF 4 + 2H 2 O
सिलिकॉन फ्लोराइड एक बेरंग गैस है जिसमें "मजबूत" गंध होती है। साथ ही सिलिकॉन क्लोराइड, पानी में यह गैस दो एसिड बनाती है: सिलिकॉन और हाइड्रोफ्लोरिक। लेकिन दिलचस्प है, सिलिकॉन फ्लोराइड बनाने के लिए हाइड्रोफ्लोरोइक एसिड के साथ बातचीत कर सकता है हेक्साफ्लोरोसिलिक एसिड जिसका रासायनिक सूत्र H 2 SiF 6 है। इसके लवण और अम्ल ही जहरीले होते हैं।
सिलिकॉन
आधार धातु और अधातु
इस पाठ में आप "सिलिकॉन" विषय पर अध्ययन करेंगे। सिलिकॉन के बारे में जानकारी पर विचार करें: इसकी इलेक्ट्रॉनिक संरचना, जहां सिलिकॉन प्रकृति में है, सिलिकॉन आवंटन का अध्ययन करें, इसके भौतिक और रासायनिक गुणों की व्याख्या करें। जानें कि उद्योग और अन्य क्षेत्रों में सिलिकॉन का उपयोग कहां किया जाता है, इसका उत्पादन कैसे किया जाता है। आप सिलिका, सिलिकिक एसिड और इसके लवण - सिलिकेट्स से परिचित होंगे।
विषय: आधार धातु और अधातु
पाठ: सिलिकॉन। कुलीन गैसें
सिलिकॉन पृथ्वी की पपड़ी में सबसे आम रासायनिक तत्वों में से एक है। इसकी सामग्री लगभग 30% है। प्रकृति में, यह मुख्य रूप से सिलिकॉन डाइऑक्साइड, सिलिकेट्स और एलुमिनोसिलिकेट्स के विभिन्न रूपों के रूप में पाया जाता है।
सिलिकॉन लगभग सभी यौगिकों में टेट्रावैलेंट है। इस मामले में, सिलिकॉन परमाणु उत्तेजित अवस्था में हैं। अंजीर। 1।
इस स्थिति में जाने के लिए, 3s इलेक्ट्रॉनों में से एक 3p ऑर्बिटल्स पर एक खाली जगह पर रहता है। इस मामले में, जमीन की स्थिति में 2 अप्रकाशित इलेक्ट्रॉनों के बजाय, उत्तेजित अवस्था में सिलिकॉन परमाणु में 4 अप्रकाशित इलेक्ट्रॉन होंगे। वह विनिमय तंत्र द्वारा 4 सहसंयोजक बांड बनाने में सक्षम होगा।


सिलिकॉन परमाणु कई बांडों के गठन के लिए प्रवण नहीं होते हैं, लेकिन एकल बांड-सी-ओ- के साथ यौगिक बनाते हैं। सिलिकॉन, कार्बन के विपरीत, अलोट्रॉपी की खासियत नहीं है।
में से एक है एलोट्रोपिक संशोधन क्रिस्टलीय सिलिकॉन हैजिसमें प्रत्येक सिलिकॉन परमाणु 3 संकरण में है। अंजीर। 2, 3. क्रिस्टलीय सिलिकॉन एक धात्विक चमक के साथ गहरे भूरे रंग का एक ठोस, दुर्दम्य और टिकाऊ क्रिस्टलीय पदार्थ है। सामान्य परिस्थितियों में - एक अर्धचालक। कभी-कभी, अनाकार सिलिकॉन को सिलिकॉन के एक अन्य एलोट्रोपिक संशोधन के रूप में भी उत्सर्जित किया जाता है। यह एक गहरे भूरे रंग का पाउडर है, जो क्रिस्टलीय सिलिकॉन की तुलना में अधिक रासायनिक रूप से सक्रिय है। चाहे वह एक एलोट्रोपिक संशोधन है, एक बिंदु है।
सिलिकॉन के रासायनिक गुण
1. हैलोजन के साथ बातचीत
Si + 2F 2 → SiF 4
2. गर्म होने पर, सिलिकॉन ऑक्सीजन में जलता है, सिलिका (IV) बनता है।
Si + O 2 → SiO 2
3. उच्च तापमान पर, सिलिकॉन नाइट्रोजन या कार्बन के साथ सहभागिता करता है।
3Si + 2N 2 → Si 3 N 4
4. सिलिकॉन अम्लों के जलीय विलयन के साथ अभिक्रिया नहीं करता है। लेकिन यह क्षार में विलीन हो जाता है।
Si + 2NOH + H 2 O → Na 2 SiO 3 + 2H 2
5. जब सिलिकॉन धातुओं के साथ फ्यूज हो जाता है, तो सिलिकाइड का निर्माण होता है।
सी + 2 एमजी → एमजी 2 सी
6. सिलिकॉन सीधे हाइड्रोजन के साथ बातचीत नहीं करता है, लेकिन सिलिकॉन के हाइड्रोजन यौगिकों को पानी के साथ सिलिकाइड की बातचीत से प्राप्त किया जा सकता है।
Mg 2 Si + 4H 2 O → 2Mg (OH) 2 + SiH 4 (silane)
सिलनेक संरचना में एल्केन्स के समान हैं, लेकिन काफी प्रतिक्रियाशील हैं। सबसे स्थिर मोनोसेलेन हवा में ज्वलनशील है।
SiH 4 + 2 O 2 → SiO 2 + 2H 2 O
सिलिकॉन प्राप्त करना
सिलिकॉन सिलिकॉन ऑक्साइड (IV) से घटाकर प्राप्त किया जाता है
SiO 2 + 2Mg → Si + 2MgO
कार्यों में से एक उच्च शुद्धता सिलिकॉन प्राप्त करना है। इस प्रयोजन के लिए, तकनीकी सिलिकॉन को सिलिकॉन टेट्राक्लोराइड में स्थानांतरित किया जाता है। परिणामस्वरूप टेट्राक्लोराइड को सिलाने के लिए कम कर दिया जाता है, और गर्म होने पर सिलोन सिलिकॉन और हाइड्रोजन में विघटित हो जाता है।
सिलिकॉन दो ऑक्साइड बनाने में सक्षम है: SiO 2 - सिलिकॉन ऑक्साइड (IV) और SiO - सिलिकॉन ऑक्साइड (II)।
सीओ - सिलिकॉन ऑक्साइड (द्वितीय) - यह एक अनाकार गहरे भूरे रंग का पदार्थ है, जो सिलिकॉन ऑक्साइड (IV) के साथ सिलिकॉन की बातचीत से बनता है
सी + SiO 2 → 2 SiO.
इसकी स्थिरता के बावजूद, इस पदार्थ का उपयोग लगभग कभी नहीं किया जाता है।
सीO 2 - सिलिकॉन ऑक्साइड (चतुर्थ)


यह पदार्थ पृथ्वी की पपड़ी का 12% हिस्सा है। अंजीर। 4. यह रॉक क्रिस्टल, क्वार्ट्ज, नीलम, सिट्रीन, जैस्पर, शैलेडोनी जैसे खनिजों द्वारा दर्शाया गया है। अंजीर। 5।
SiO 2 - सिलिकॉन ऑक्साइड (IV) - गैर-आणविक संरचना का एक पदार्थ।
इसका क्रिस्टल जाली परमाणु है। अंजीर। 6. SiO 2 क्रिस्टल में टेट्राहेड्रॉन का रूप होता है, जो ऑक्सीजन परमाणुओं द्वारा परस्पर जुड़े होते हैं। (SiO 2) n अणु का सूत्र अधिक सही होगा। चूंकि SiO 2 परमाणु संरचना का एक पदार्थ बनाता है, और CO 2 - आणविक संरचना का, उनके गुणों में अंतर स्पष्ट है। CO 2 एक गैस है, और SiO 2 एक ठोस पारदर्शी क्रिस्टलीय पदार्थ है, जो पानी में अघुलनशील और दुर्दम्य है।
रासायनिक गुणसीलगभग २
1. सिलिकॉन ऑक्साइड (IV) SiO 2 एक एसिड ऑक्साइड है। यह पानी के साथ प्रतिक्रिया नहीं करता है। SiO के जलयोजन से सिलिकिक अम्ल प्राप्त नहीं किया जा सकता है। इसके लवण, सिलिकेट, SiO 2 को गर्म क्षार के घोल से प्रतिक्रिया करके प्राप्त किए जा सकते हैं।
SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O
2. क्षार और क्षारीय पृथ्वी धातुओं के कार्बोनेट के साथ प्रतिक्रिया करता है।
CaCO 3 + SiO 2 CaSiO 3 + CO 2
3. धातुओं के साथ सहभागिता करता है।
SiO 2 + 2Mg → Si + 2MgO
4. हाइड्रोफ्लोरिक एसिड के साथ प्रतिक्रिया।
SiO 2 + 4HF → SiF 4 + 2H 2 O
SiF 4 + 2HF → H 2
सिलिकिक एसिड और सिलिकेट्स के रासायनिक गुण
सिलिकिक एसिड प्राप्त करना
सिलिकिक एसिड एक बहुलक यौगिक के रूप में अवक्षेपित होता है। सिलिकिक एसिड सूत्र -
H 2 SiO 3 (मेटा फॉर्म) और H 4 SiO 4 (ऑर्थो फॉर्म) - तत्वों के अनुपात को दर्शाते हैं, लेकिन सही रचना नहीं। विमान पर, पारंपरिक रूप से, सिलिकिक एसिड की संरचना को अंजीर के रूप में दर्शाया गया है। 7।
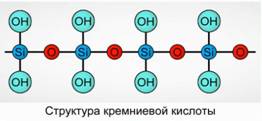
सिलिकिक एसिड के लिए, सूत्र H 2 SiO 3 का उपयोग हमेशा किया जाता है।
1. एच 2 SiO 3 गर्म होने पर विघटित हो जाता है
H 2 SiO 3 H 2 O + SiO 2 (सिलिका जेल)
2. क्षार समाधान के साथ बातचीत करता है
H 2 SiO 3 + 2NaOH Na 2 SiO 3 + 2H 2 O
सिलिकिक एसिड लवण - सिलिकेट - आयनिक यौगिकों का संदर्भ लें। ये ठोस रंगहीन पदार्थ होते हैं। केवल क्षार धातु सिलिकेट, लिथियम को छोड़कर, पानी में घुलनशील हैं।
1. आयनों द्वारा घुलनशील सिलिकेट्स को हाइड्रोलाइज्ड किया जाता है
Na 2 SiO 3 + H 2 O Si NaHSio 3 + NaOH
2. घुलनशील सिलिकेट्स मजबूत एसिड के साथ बातचीत करते हैं।
Na 2 SiO 3 + 2HCl → H 2 SiO 3 N + 2NaCl
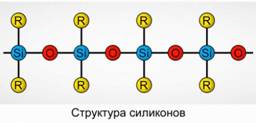
पॉलीऑर्गोनोसिलॉक्स (सिलिकोन)
Polyorganosiloxanes (silicones) ऑक्सीजन युक्त, उच्च आणविक भार ऑर्गोसिलिकॉन यौगिक होते हैं।
आर 2 [ SiO] n
आर एक कार्बनिक समूह (मिथाइल, एथिल या फिनाइल) है। सिलोक्सों की संरचना का आधार वैकल्पिक सिलिकॉन परमाणुओं और ऑक्सीजन की एक श्रृंखला है। चित्र 8। श्रृंखला और कार्बनिक समूहों की लंबाई को अलग करके, विभिन्न गुणों वाले सिलिकोन प्राप्त किए जा सकते हैं। पोलीमराइजेशन की स्थितियों को बदलकर, आप विभिन्न लंबाई के अणु प्राप्त कर सकते हैं।


लघु श्रृंखला पॉलिमर तरल होते हैं, लंबे समय तक मूल्यवान स्नेहक होते हैं। अंजीर। 9, जो अपने गुणों को एक विशाल तापमान सीमा से बनाए रखते हैं
100 0 С से + 300 0 С. लंबे समय तक अणु ऐसे घिसते हैं जो कम तापमान पर अपनी लोच नहीं खोते हैं। पोषाहार के लिए उच्च प्रतिरोध, रासायनिक रूप से निष्क्रिय हैं। अंजीर। 10. यह उनके आवेदन के विभिन्न रूपों का कारण बनता है। उनका उपयोग कृत्रिम दिल या गुर्दे की मशीन बनाने के लिए किया जा सकता है, और जूते के लिए जूते के रूप में इस्तेमाल किया जा सकता है। सिलोक्सेन पॉलिमर का उपयोग विभिन्न नरम ऊतक प्रत्यारोपण बनाने के लिए दवा में किया जाता है, क्योंकि ऐसे पॉलिमर रासायनिक रूप से निष्क्रिय होते हैं और शरीर द्वारा अस्वीकार नहीं किए जाते हैं। उन्हें पानी से सिक्त नहीं किया जाता है। इसका उपयोग क्रीम में किया जाता है। अपने हाथों पर इस क्रीम को लगाते समय, वह रबर के दस्ताने को बदल देगा।
अकार्बनिक उद्यान
सोडियम सिलिकेट से भरे पारदर्शी बीकर में, रंगीन लवण जैसे क्रिस्टल को कॉपर सल्फेट में डुबोएं। कुछ समय बाद, यह देखा जा सकता है कि क्रिस्टल से बनी पतली खोखली नलियाँ, जिनमें अघुलनशील सिलिकेट होते हैं। अंजीर। 11।

"बेवकूफ" पोटीन प्राप्त करना
सोडियम सिलिकेट और मेडिकल अल्कोहल के बराबर मात्रा में मिलाया जाता है। अवक्षेप को फ़िल्टर्ड किया जाता है और निचोड़ा जाता है ताकि अल्कोहल ड्रिप न हो। यह पोटीन है। अंजीर। 12. इसे इसलिए नाम दिया गया क्योंकि इसे खिड़कियों के लिए पोटीन के रूप में उपयोग करने की योजना बनाई गई थी। लेकिन यह पता चला कि इसमें ऐसे गुण हैं कि इसका उपयोग अपने इच्छित उद्देश्य के लिए नहीं किया जा सकता है। यदि आप गेंद को रोल करते हैं और इसे फर्श पर फेंकते हैं, तो यह रबड़ की गेंद की तरह उछल जाएगी। यदि मेज पर रखा जाता है, तो यह एक तरल की तरह फैल जाएगा। यदि आप किसी ठोस वस्तु से टकराते हैं, तो यह एक ठोस पिंड की तरह बिखर जाएगा। थोड़ी देर बाद, जब शराब सूख जाती है, तो यह पोटीन बस उखड़ जाएगी।
![]()
सबक सीखकर
इस पाठ में, आपने "सिलिकॉन" विषय का अध्ययन किया है। हमने सिलिकॉन के बारे में जानकारी की जांच की: इसकी इलेक्ट्रॉनिक संरचना, जहां सिलिकॉन प्रकृति में स्थित है, सिलिकॉन के आवंटन का अध्ययन किया, इसके भौतिक और रासायनिक गुणों के बारे में बताया। उन्होंने सीखा कि उद्योग और अन्य क्षेत्रों में सिलिकॉन का उपयोग कहां किया जाता है, इसका उत्पादन कैसे किया जाता है। आप सिलिका, सिलिकिक एसिड और इसके लवण - सिलिकेट्स से मिले।
संदर्भ
1. रुडजाइटिस जी.ई. रसायन विज्ञान। सामान्य रसायन विज्ञान की मूल बातें। ग्रेड 11: शैक्षिक संस्थानों के लिए पाठ्यपुस्तक: बुनियादी स्तर / जी.ई. रुडजाइटिस, एफ.जी. फेल्डमैन। - 14 वां संस्करण। - एम ।: प्रबुद्धता, 2012।
2. पोपेल पी.पी. रसायन विज्ञान: 8 सीएल .: माध्यमिक विद्यालयों / पीपी के लिए पाठ्यपुस्तक। पोपेल, एल.एस. - К।: И К "अकादमी", 2008. - 240 पी .: बीमार।
3. गैब्रिएलन ओ.एस. रसायन विज्ञान। 11 वीं कक्षा। मूल स्तर। दूसरा संस्करण, सीनियर - एम ।: ड्रोफ, 2007। - 220 पी।
घर का पाठ
1. itis2-4 (पृष्ठ 138) रुडजाइटिस जी.ई. रसायन विज्ञान। सामान्य रसायन विज्ञान की मूल बातें। ग्रेड 11: शैक्षिक संस्थानों के लिए पाठ्यपुस्तक: बुनियादी स्तर / जी.ई. रुडजाइटिस, एफ.जी. फेल्डमैन। - 14 वां संस्करण। - एम ।: प्रबुद्धता, 2012।
2. पॉलीऑर्गानोसिलॉक्सन के अनुप्रयोग क्या हैं।
3. सिलिकॉन के एलोट्रोपिक संशोधनों के गुणों की तुलना करें।
