Sumpor. Vodikov sulfid i sulfidi
4.doc
240Sumpor. Vodikov sulfid, sulfidi, hidrosulfidi. Oksidi sumpora (IV) i (VI). Sumporna kiselina i sumporna kiselina i njihove soli. Esteri sumporne kiseline. Natrijum tiosulfat
4.1. Sumpor
Sumpor je jedan od rijetkih kemijskih elemenata koje su ljudi koristili nekoliko milenijuma. Široko je rasprostranjen u prirodi i nalazi se iu slobodnom stanju (prirodni sumpor) iu jedinjenjima. Minerali koji sadrže sumpor mogu se podeliti u dve grupe - sulfidi (piriti, gliteri, lutke) i sulfati. Prirodni sumpor se nalazi u velikim količinama u Italiji (ostrvo Sicilija) i SAD-u. U ZND, prirodne naslage sumpora nalaze se u regionu Volge, u državama centralne Azije, na Krimu i drugim područjima.
U minerale prve grupe spadaju olovni sjaj PbS, bakar Cu 2 S, srebrni sjaj - Ag 2 S, cink snag - ZnS, kadmijum snag - CdS, pirit ili gvožđe pirit - FeS 2, halkopirit - CuFeS 2, cinabar - HgS.
Minerali druge grupe uključuju gips CaSO 4 2H 2 O, mirabilit (Glauberova sol) - Na 2 SO 4 10H 2 O, i kizerite - MgSO 4 H 2 O.
Sumpor se nalazi u životinjama i biljkama, kao dio molekula proteina. Organska jedinjenja sumpora nalaze se u nafti.
Getting
1. Kada se sumpor dobija iz prirodnih jedinjenja, na primer, iz piritnog sumpora, zagreva se do visokih temperatura. Sumporni pirit razgrađuje se u željezni (II) sulfid i sumpor:
2. Sumpor se može dobiti oksidacijom sumporovodika zbog nedostatka kisika reakcijom:
2H 2 S O 2 = 2S 2H 2 O
3. Danas, rekuperacija sumpora sa sumpor-dioksidom SO 2 redukcijom ugljičnog dioksida je uobičajeni nusproizvod u taljenju metala iz sumpornih ruda:
SO 2 C = CO 2 S
4. Otpadni gasovi metalurške i koksne peći sadrže mješavinu sumpor dioksida i vodikovog sulfida. Ova mješavina se prenosi na visokoj temperaturi preko katalizatora:
H 2 S SO 2 = 2H 2 O 3S
^ Fizička svojstva
Sumpor je tvrda, krhka limun žuta boja. Praktično je nerastvorljiv u vodi, ali dobro rastvorljiv u CS 2 anilinu u ugljikovom disulfidu i nekim drugim otapalima.
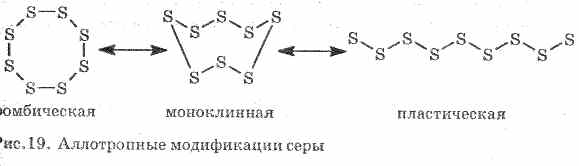
Loše provodi toplinu i električnu struju. Sumpor formira nekoliko alotropnih modifikacija:
1 . ^ Romski sumpor (najstabilniji), kristali imaju oblik oktaedra.
Kada se sumpor zagreva, njegova boja i viskoznost se menjaju: prvo se formira svetlo žuta, a zatim, kako se temperatura povećava, potamni i postaje toliko viskozna da ne izlazi iz cevi, pri daljnjem zagrevanju, viskozitet ponovo pada, a na 444, 6 ° S sumpor .
2. ^ Monoklinski sumpor - modifikacija u obliku tamno žutih iglica, dobijenih polaganim hlađenjem rastopljenog sumpora.
3. Plastični sumporformira se ako se sumpor zagrijan do ključanja izlije u hladnu vodu. Lako se rasteže poput gume (vidi sliku 19).
Prirodni sumpor se sastoji od mješavine četiri stabilna izotopa: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
^ Hemijska svojstva
Atom sumpora, koji ima nepotpun spoljašnji nivo energije, može vezati dva elektrona i pokazati stepen
Oksidacija -2. Sumpor pokazuje takvo oksidacijsko stanje u spojevima s metalima i vodikom (Na2S, H2S). Kada se odbije ili osiromaši elektrona do atoma više elektronegativnog elementa, stepen oksidacije sumpora može biti 2, 4, 6.
Sumpor je relativno hladan na hladnom, ali sa povećanjem temperature, njegova reaktivnost se povećava. 1. Kod metala sumpor pokazuje oksidativna svojstva. Kada ove reakcije formiraju sulfide (sa zlatom, platinom i iridijem ne reaguje): Fe S = FeS
2. U normalnim uvjetima, sumpor ne reagira s vodikom, a na 150–200 ° C dolazi do reverzibilne reakcije:
3. U reakcijama sa metalima i vodikom, sumpor se ponaša kao tipičan oksidacioni agens, au prisustvu jakih oksidacionih sredstava ima redukcione osobine.
S 3F 2 = SF 6 (ne reaguje s jodom)
4. Spaljivanje sumpora u kiseoniku odvija se na 280 ° C, a na zraku na 360 ° C. Ovo formira mješavinu SO 2 i SO 3:
S O 2 = SO 2 2S 3O 2 = 2SO 3
5. Kada se greje bez vazduha, sumpor se direktno kombinuje sa fosforom, ugljenikom, pokazujući oksidativna svojstva:
2P 3S = P 2 S 3 2S C = CS 2
6. U interakciji sa kompleksnim supstancama, sumpor se uglavnom ponaša kao redukcioni agens:
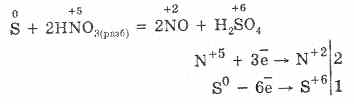
7. Sumpor je sposoban za reakcije disproporcionacije. Dakle, kada se kuva sumporni prah sa alkalijama, formiraju se sulfiti i sulfidi:
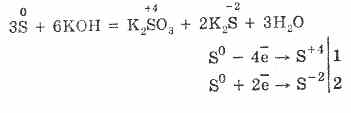
Application
Sumpor se široko koristi u industriji i poljoprivredi. Oko polovine njegove proizvodnje troši se na proizvodnju sumporne kiseline. Sumpor se koristi za vulkanizaciju gume: u ovom slučaju, guma se pretvara u gumu.
U obliku sumpora (fini prah) sumpor se koristi za borbu protiv bolesti vinograda i pamuka. Koristi se za dobijanje baruta, šibica, sjajnih kompozicija. U medicini, pripremljena sumporna mast za liječenje kožnih bolesti.
4.2. Vodikov sulfid, sulfidi, hidrosulfidi
Vodonik sulfid je analog vode. Njegova elektronska formula
To pokazuje da su dva p-elektrona eksternog nivoa atoma sumpora uključena u formiranje H-S-H veza. H 2 S molekula ima ugaoni oblik, tako da je polarna.
^ Biti u prirodi
Vodikov sulfid se nalazi u prirodi u vulkanskim gasovima iu vodama nekih mineralnih izvora, kao što su Pyatigorsk, Matsesta. Formira se raspadanjem organskih supstanci koje sadrže sumpor iz različitih životinjskih i biljnih ostataka. Ovo objašnjava karakterističan neugodan miris kanalizacije, septičkih jama i deponija.
Getting
1. Sulfid vodika može se dobiti direktnom vezom sumpora s vodikom zagrijavanjem:
2. Ali obično se dobija dejstvom razblažene hlorovodonične ili sumporne kiseline na sulfid gvožđa (III):
2HCl FeS = FeCl 2 H 2 S 2H FeS = Fe 2 H 2 S Ova reakcija se često izvodi u Kippovom aparatu.
^ Fizička svojstva
U normalnim uslovima, sumporovodik je bezbojni gas sa snažnim karakterističnim mirisom pokvarenih jaja. Veoma otrovna, inhalacija se vezuje za hemoglobin, uzrokujući paralizu, što je nezdravo.
Ko dovodi do smrti. U niskim koncentracijama, manje opasan. Potrebno je raditi s njim u ispušnim ormarima ili hermetički zatvorenim uređajima. Dozvoljeni sadržaj H 2 S u proizvodnim prostorijama je 0,01 mg na 1 litru vazduha.
Vodikov sulfid je relativno dobro rastvorljiv u vodi (pri 20 ° C 2,5 volumena vodonik sulfida se otopi u 1 volumenu vode).
Rastvor vodonik-sulfida u vodi naziva se vodik-sulfidna voda ili sumporovodik-kiselina (detektira osobine slabe kiseline).
^ Hemijska svojstva
1, Kada se snažno zagreje, vodonik-sulfid se skoro u potpunosti razgrađuje i formira sumpor i vodonik.
2. Plinoviti sumporovodik gori u zraku plavim plamenom s formiranjem sumpor oksida (IV) i vode:
2H2S3O2 = 2SO2 2H2O
Sa nedostatkom kiseonika, formiraju se sumpor i voda: 2H 2 S O 2 = 2S 2H 2 O
3. Vodikov sulfid je prilično jak redukcijski agens. Ova važna kemijska svojstva mogu se objasniti na sljedeći način. U rastvoru H2S relativno je lako donirati elektrone molekulama kisika u vazduhu:
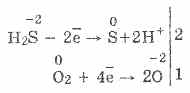
Istovremeno, kiseonik u zraku oksidira vodik sulfid do sumpora, što čini sumporovodik mutnom:
2H 2 S O 2 = 2S 2H 2 O
To objašnjava činjenicu da se sumporovodik ne akumulira u velikim količinama u prirodi kada se organska materija raspada - kiseonik iz zraka oksidira u slobodni sumpor.
4, Vodikov sulfid snažno reaguje sa halogenim rastvorima, na primer:
H 2 S I 2 = 2HI S Sumpor se oslobađa i otopina joda postaje bezbojna.
5. Različiti oksidanti reagiraju snažno sa sumporovodikom: pod djelovanjem dušične kiseline nastaje slobodni sumpor.
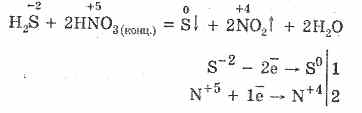
6. Otopina hidrogen sulfida je kisela zbog disocijacije:
H 2 SH HS - HS - SH S -2
Prva faza obično prevladava. To je vrlo slaba kiselina: slabija od ugljene kiseline, koja obično zamjenjuje H2S iz sulfida.
Sulfidi i hidrosulfidi
Fluorovodična kiselina, kao dvobazična, formira dva reda soli:
Srednji - sulfidi (Na 2 S);
Kiselo-hidrosulfidi (NaHS).
Ove soli se mogu dobiti: interakcijom hidroksida sa sumporovodikom: 2NaOHH 2 S = Na 2 S 2H 2 O
Direktna interakcija sumpora sa metalima:
Reakcija razmene soli sa H 2 S ili između soli:
Pb (NO 3) 2 Na 2 S = PbS 2NaNO 3
CuSO4H2S = CuS2H2SO4Cu2H2S = CuS2H
Hidrosulfidi su skoro svi topljivi u vodi.
Sulfidi alkalnih i zemnoalkalnih metala su takođe lako rastvorljivi u vodi, bezbojni.
Sulfidi teških metala su praktički nerastvorljivi ili slabo topljivi u vodi (FeS, MnS, ZnS); Neke od njih se ne rastvaraju u razrijeđenim kiselinama (CuS, PbS, HgS).
Kao soli slabe kiseline, sulfidi u vodenim rastvorima su visoko hidrolizirani. Na primer, sulfidi alkalnih metala, kada se rastvore u vodi, imaju alkalnu reakciju:
Na 2 S NONNaHS NaOH
Svi sulfidi, kao i sam sulfid, su snažni redukcioni agensi:
3PbS -2 8HN 5 O 3 (par.) = 3PbS 6 O 4 4H 2 O 8N 2 O
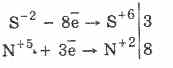
Neki sulfidi imaju karakterističnu boju: CuS i PbS - crni, CdS - žuti, ZnS - bijeli, MnS - ružičasti, SnS - smeđi, Al 2 S 3 - narančasti. Kvalitativna analiza kationa temelji se na različitim topljivostima sulfida i različitim bojama mnogih od njih.
^ 4.3. Sumpor-oksid (IV) i sumporna kiselina
Sumpor oksid (IV), ili sumpor dioksid, u normalnim uslovima, je bezbojni gas sa oštrim mirisom koji guši. Kada se ohladi na -10 ° C, ukapljuje se u bezbojnu tekućinu.
Getting
1. U laboratorijskim uslovima, sumpor oksid (IV) se dobija iz soli sumporne kiseline dejstvom jakih kiselina na njih:
Na 2 SO 3 H 2 SO 4 = Na 2 SO 4 S0 2 O H 2 O 2NaHSO 3 H 2 SO 4 = Na 2 SO 4 2SO 2 H 2H 2 O 2HSO - 3 2H = 2 SO 2 2H 2 O
2. Takođe, sumporni dioksid nastaje interakcijom koncentrisane sumporne kiseline pri zagrevanju sa nisko-aktivnim metalima:
Cu 2H 2 SO 4 = CuSO 4 SO 2 H 2H 2 O
Cu 4H 2 SO 2-4 = Cu 2 SO 2-4 SO 2 H 2H 2 O
3. Sumporni oksid (IV) nastaje i kada se sumpor sagorijeva u zraku ili kisiku:
4. U industrijskim uslovima, SO 2 se dobija prženjem pirita sa FeS 2 ili sumpornim rudama obojenih metala (cink blend ZnS, olovni sjaj PbS, itd.):
4FeS 2 11O 2 = 2Fe 2 O 3 8SO 2
Strukturna formula molekula SO 2:
Četiri atoma sumpora i četiri elektrona iz dva atoma kiseonika učestvuju u formiranju veza u molekuli SO2. Uzajamno odbijanje parova vezujućih elektrona i usamljeni elektronski par sumpora daje molekulu ugaoni oblik.
Hemijska svojstva
1. Sumpor oksid (IV) pokazuje sva svojstva kiselih oksida:
Interakcija vode
Interakcija sa alkalijama
Interakcija sa osnovnim oksidima.
2. Oksid sumpora (IV) karakteriše redukcijska svojstva:
S 4 O 2 O 0 2 S 2S 6 O -2 3 (u prisustvu katalizatora, kada se zagreva)
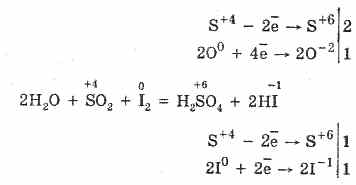
Ali u prisustvu jakih redukcionih sredstava, SO 2 se ponaša kao oksidacioni agens:
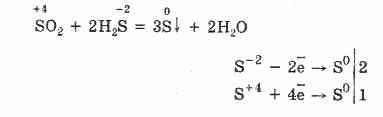
Redoks-dualnost sumpornog (IV) oksida objašnjava se činjenicom da sumpor ima oksidaciono stanje 4 u njemu, te stoga može, dajući 2 elektrona, biti oksidirano do S 6, a uzimanjem 4 elektrona može se reducirati na S °. Manifestacija ovih ili drugih svojstava zavisi od prirode reaktivne komponente.
Oksid sumpora (IV) je visoko rastvorljiv u vodi (40 zapremina SO2 se otopi u 1 zapremini na 20 ° C). U ovom slučaju, formira se sumporna kiselina koja postoji samo u vodenom rastvoru:
SO2H2OH2SO3
Reakcija je reverzibilna. U vodenom rastvoru, sumpor oksid (IV) i sumporna kiselina su u hemijskoj ravnoteži, što se može pomeriti. Sa vezivanjem H 2 SO 3 (neutralizacija kiseline
Vi) reakcija se odvija u smjeru stvaranja sumporne kiseline; pri uklanjanju SO 2 (duvanje kroz rastvor azota ili zagrevanje), reakcija se nastavlja prema početnim materijalima. Rastvor sumporne kiseline uvek sadrži oksid sumpora (IV), što mu daje oštar miris.
Sumporna kiselina ima sva svojstva kiselina. U rešenju se razdvaja u koracima:
H 2 SO 3 H H HSO - 3 HSO - 3 SO H SO 2- 3
Termički nestabilan, nestabilan. Sumporna kiselina, kao dibazična, formira dvije vrste soli:
Srednji - sulfiti (Na 2 SO 3);
Kiselo-hidrosulfit (NaHSO 3).
Sulfiti nastaju kada se alkali potpuno neutrališu kiselinom:
H 2 SO 3 2NaOH = Na 2 SO 3 2H 2 O
Hidrosulfiti se dobijaju uz nedostatak alkalija:
H 2 SO 3 NaOH = NaHS03H2O
Sumporna kiselina i njene soli imaju i oksidirajuća i reduktivna svojstva, što je određeno prirodom reakcionog partnera.
1. Dakle, pod dejstvom kiseonika sulfiti se oksidiraju u sulfate:
2Na 2 S 4 O 3 O 0 2 = 2Na 2 S 6 O -2 4
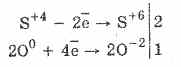
Oksidacija sumporne kiseline bromom i kalijum permanganatom se odvija još lakše:
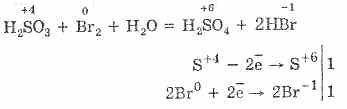
5H 2 S 4 O 3 2KMn 7 O 4 = 2H 2 S 6 O 4 2Mn 2 S 6 O 4 K 2 S 6 O 4 3H 2 O
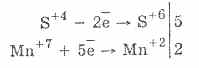
2. U prisustvu snažnijih redukcionih sredstava, sulfiti pokazuju oksidativna svojstva:
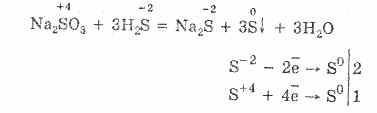
Gotovo svi hidrosulfiti i sulfiti alkalnih metala rastvaraju se iz soli sumporne kiseline.
3. Budući da je H2S03 slaba kiselina, djelovanje kiselina na sulfite i hidrosulfite dovodi do oslobađanja SO2. Ova metoda se obično koristi pri dobivanju SO 2 u laboratorijskim uslovima:
NaHS03H2SO4 = Na2S04S022H2O
4. Vodotopivi sulfiti se lako podvrgavaju hidrolizi, što rezultira povećanjem koncentracije OH - iona u otopini:
Na 2 SO 3 NON-NaHSO 3 NaOH
Application
Sumporni oksid (IV) i sumporna kiselina obezbojenjuju mnoge boje, formirajući sa njima bezbojna jedinjenja. Potonji se mogu ponovo razgraditi kada se zagriju ili na svjetlu, zbog čega se boja ponovo uspostavlja. Prema tome, efekat izbjeljivanja SO 2 i H 2 SO 3 se razlikuje od efekta izbjeljivanja klora. Obično sumpor (IV) izbjeljuje vunu, svilu i slamu.
Sumpor oksid (IV) ubija mnoge mikroorganizme. Zbog toga, da bi se uništili plijesni, oni fumigiraju sirove podrume, podrume, vinske bačve, itd. Koristi se i za transport i skladištenje voća i bobičastog voća. U velikim količinama, sumpor oksid IV) se koristi za proizvodnju sumporne kiseline.
Važna primjena je otopina kalcijevog hidrosulfita CaHSO 3 (sulfitna tekućina), koja se koristi za obradu drva i papirne pulpe.
^ 4.4. Sumpor-oksid (VI). Sumporna kiselina
Oksid sumpora (VI) (vidi tab. 20) je bezbojna tečnost koja se očvršćava na temperaturi od 16,8 ° C do čvrste kristalne mase. Jako upija vlagu, formirajući sumpornu kiselinu: SO3H2O = H2S04
Tabela 20. Svojstva oksida sumpora
Otapanje oksida sumpora (VI) u vodi prati oslobađanje značajne količine toplote.
Oksid sumpora (VI) je vrlo topiv u koncentriranoj sumpornoj kiselini. Rastvor SO3 u bezvodnoj kiselini naziva se oleum. Oleumi mogu sadržavati do 70% SO3.
Getting
1. Sumpor-oksid (VI) se dobija oksidacijom sumpor-dioksida kisikom u prisustvu katalizatora na temperaturi od 450 ° C (vidi Proizvodnja sumporne kiseline):
2SO2O2 = 2SO3
2. Drugi način za oksidaciju SO 2 u SO 3 je upotreba nitratnog (IV) oksida kao oksidirajućeg sredstva:
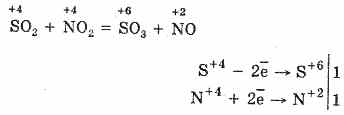
Dobiveni azotni oksid (II), kada u interakciji s atmosferskim kisikom lako i brzo prelazi u dušikov oksid (IV): 2NO O 2 = 2NO 2
Koji se opet mogu koristiti u oksidaciji SO 2. Dakle, NO 2 djeluje kao nosač kisika. Ova metoda oksidacije SO 2 u SO 3 naziva se nitroz. Molekul SO 3 ima oblik trougla, u čijem središtu je
Atom sumpora se nalazi:
Takva struktura je posljedica međusobnog odbijanja parova elektronskih veza. Atom sumpora obezbedio je šest spoljnih elektrona za njihovo formiranje.
Hemijska svojstva
1. SO3 je tipičan kiseli oksid.
2. Sumpor oksid (VI) ima svojstva jakog oksidirajućeg sredstva.
Application
Za proizvodnju sumporne kiseline koristi se sumporni oksid (VI). Najvažniji je kontaktni metod dobijanja
Sumporna kiselina. Ovom metodom možete dobiti H 2 SO 4 bilo koje koncentracije, kao i oleum. Proces se sastoji od tri faze: dobijanje SO 2; oksidacija SO 2 u SO 3; dobijanje H2S04.
SO 2 se dobija sagorevanjem pirita FeS 2 u posebnim pećima: 4FeS 2 11O 2 = 2Fe 2 O 3 8SO 2
Da bi se ubrzao prženje, pirit je predzemni, a za potpunije sagorevanje sumpora, ubrizgava se znatno više vazduha (kiseonika) nego što je potrebno reakciji. Plin koji izlazi iz peći sastoji se od sumpornog (IV) oksida, kiseonika, azota, jedinjenja arsena (od nečistoća u piritima) i vodene pare. Zove se gas za pečenje.
Gas za prženje se temeljito čisti, jer čak i mali sadržaj spojeva arsena, kao i prašina i vlaga, truju katalizator. Gas se čisti od spojeva arsena i prašine, prolazi kroz specijalne elektrostatičke taložnike i toranj za pranje; vlagu upija koncentrovana sumporna kiselina u sušari. Prečišćeni gas koji sadrži kiseonik se zagreva u izmenjivaču toplote do 450 ° C i ulazi u kontaktni aparat. Unutar kontaktnog aparata nalaze se rešetkaste police napunjene katalizatorom.
Ranije je kao katalizator korištena fino usitnjena metalna platina. Zatim je zamenjen vanadijumskim jedinjenjima - vanadijum oksidom (V) V 2 O 5 ili vanadil sulfatom VOSO 4, što je jeftinije od platine i sporije otrovano.
Reakcija oksidacije SO 2 u SO 3 je reverzibilna:
2SO 2 O 2 2SO 3
Povećanje sadržaja kiseonika u kalcinacionom gasu povećava prinos sumpornog oksida (VI): na temperaturi od 450 ° C, obično doseže 95% ili više.
Formirani oksid sumpora (VI) se zatim dovodi metodom protustruje u apsorpcioni toranj, gdje se apsorbira koncentriranom sumpornom kiselinom. Kako zasićuje, prvo se formira bezvodna sumporna kiselina, a zatim oleum. U budućnosti, oleum se razređuje do 98% sumporne kiseline i isporučuje potrošačima.
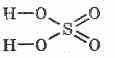
Strukturna formula sumporne kiseline:
^ Fizička svojstva
Sumporna kiselina je teška, bezbojna, uljana tekućina koja kristalizira na 10,4 ° C, gotovo dvostruko ( = 1,83 g / cm 3) je teži od vode, bez mirisa, nehlapljiv. Izuzetno higroskopan. Vlaga upija sa oslobađanjem velikih količina toplote, tako da ne možete sipati vodu u koncentrovanu sumpornu kiselinu - doći će do prskanja kiseline. For the
Sumporna kiselina se mora dodati u vodu u malim porcijama.
Bezvodna sumporna kiselina rastvara do 70% sumpornog oksida (VI). Prilikom zagrijavanja uklanja se SO3 dok se ne dobije 98,3% masenog udjela H 2 SO 4. Bezvodni H 2 SO 4 gotovo ne provodi električnu struju.
^ Hemijska svojstva
1. Miješa se s vodom u svim omjerima i formira hidrate različitog sastava:
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 3H 2 O, H 2 SO 4 4H 2 O, H 2 SO 4 6,5 H 2 O
2. Koncentrisana sumporna kiselina karbonizira organsku materiju - šećer, papir, drvo, vlakna, oduzimajući im elemente vode:
C 12 H 22 O 11 H 2 SO 4 = 12 C H 2 SO 4 11H 2 O
Formirani ugalj djelomično djeluje s kiselinom:
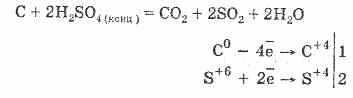
Dehidracija gasa se bazira na upijanju vode sumpornom kiselinom.
Kao jaka nehlapljiva kiselina, H 2 SO 4 zamjenjuje druge kiseline iz suhih soli:
NaNO 3 H 2 SO 4 = NaHSO 4 HNO 3
Međutim, ako se H 2 SO 4 dodaje u otopine soli, ne dolazi do istiskivanja kiseline.
H 2 SO 4 - jaka dvobazna kiselina: H 2 SO 4 HH HSO - 4 HSO - 4 SOH SO 2- 4
Ima sva svojstva nehlapljivih jakih kiselina.
Razređenu sumpornu kiselinu karakterišu sva svojstva neoksidirajućih kiselina. Naime: ona je u interakciji s metalima koji su u elektrokemijskoj seriji napona metala do vodika:
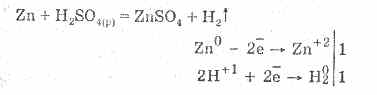
Interakcija sa metalima je posledica redukcije jona vodonika.
6. Koncentrisana sumporna kiselina je energetski oksidacioni agens. Kada se zagreva, oksidira većinu metala, uključujući i one u elektrokemijskom nizu naprezanja nakon vodonika, ne reaguje samo sa platinom i zlatom. U zavisnosti od aktivnosti metala, produkti redukcije mogu biti S -2, S ° i S 4.
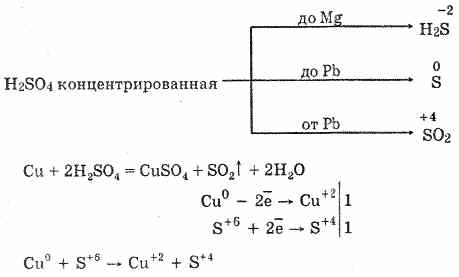
U hladnoj, koncentrovanoj sumpornoj kiselini nije u interakciji sa tako jakim metalima kao što su aluminijum, gvožđe i hrom. To je zbog pasivizacije metala. Ova osobina se široko koristi kada se transportuje u kontejneru od gvožđa.
Međutim, kada se grije:
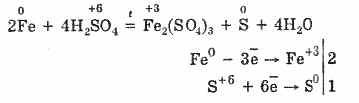
Tako koncentrirana sumporna kiselina stupa u interakciju s metalima zbog redukcije atoma koji stvaraju kiselinu.
Kvalitativna reakcija na sulfatni ion SO 2-4 je formiranje bijelog kristalnog taloga BaSO 4, netopljivog u vodi i kiselinama:
SO 2- 4 Ba 2 SO BaSO 4
Application
Sumporna kiselina je najvažniji proizvod glavne hemijske industrije koja se bavi proizvodnjom ne-
Organske kiseline, baze, soli, mineralna đubriva i hlor.
Za različite primene sumporna kiselina je na prvom mestu među kiselinama. Najveća količina se troši za dobijanje fosfatnih i azotnih đubriva. Sumporna kiselina se koristi kao nehlapljiva kiselina za proizvodnju drugih kiselina - solne, fluorovodične, fosforne i octene.
Mnogo toga se odnosi na prečišćavanje naftnih derivata - benzina, kerozina, mazivih ulja - od štetnih nečistoća. U mašinstvu, sumporna kiselina čisti metalnu površinu od oksida pre nanošenja premaza (niklovanje, hromiranje, itd.). Sumporna kiselina se koristi u proizvodnji eksploziva, umjetnih vlakana, boja, plastike i mnogih drugih. Koristi se za punjenje baterija.
Soli sumporne kiseline su važne.
^ Natrijum sulfatNa 2 SO 4 kristalizira iz vodenih otopina u obliku hidrata Na 2 SO 4 10H 2 O, koji se naziva Glauberova sol. Koristi se u medicini kao laksativ. Bezvodni natrijum sulfat se koristi u proizvodnji sode i stakla.
^ Amonijev sulfat(NH 4) 2 SO 4 - azotno đubrivo.
Kalijum sulfatK 2 SO 4 - gnojivo za potašu.
Kalcijum sulfat CaSO 4 se nalazi u prirodi kao gipsani mineral CaSO 4 2H 2 O. Kada se zagreje na 150 ° C, gubi dio vode i prelazi u hidrat 2CaSO 4 H 2 O, koji se zove spaljeni gips ili alabaster. Kada se pomeša sa vodom u pastoznu masu, alabaster se ponovo stvrdne nakon nekog vremena, pretvarajući se u CaSO 4 2H 2 O. Gips se naširoko koristi u građevinarstvu (gips).
Magnezijum sulfatMgSO 4 se nalazi u morskoj vodi, uzrokujući njen gorak ukus. Kristalni hidrat, nazvan gorka so, koristi se kao laksativ.
Vitriol- tehnički naziv kristalnih hidrata metalnih sulfata Fe, Cu, Zn, Ni, Co (dehidrirane soli nisu vitriji). Copper sulfateCuSO 4 5H 2 O je plava otrovna supstanca. Biljke se poprskaju razblaženim rastvorom i seme se poseju pre setve. Iron vitriolFeSO 4 7H 2 O je svetlozelena supstanca. Koristi se za kontrolu štetočina biljaka, boja, mineralnih boja, itd. Cink sulfatZnSO 4 7H 2 O se koristi u proizvodnji mineralnih boja, u sittoprechatanii, medicini.
^ 4.5. Esteri sumporne kiseline. Natrijum tiosulfat
Esteri sumporne kiseline uključuju dialkil sulfate (RO 2) SO 2. To su tečnosti visokog ključanja; manje rastvorljiv u vodi; u prisustvu alkalija formiraju se alkohol i soli sumporne kiseline. Niži dialkil sulfati su alkilirajući agensi.
Dietil sulfat(C 2 H 5) 2 SO 4. Tačka topljenja -26 ° C, vrelište 210 ° C, rastvorljivo u alkoholima, nerastvorljivo u vodi. Dobija se reakcijom sumporne kiseline sa etanolom. Je sredstvo za etiliranje u organskoj sintezi. Prodire u kožu.
Dimetil sulfat(CH 3) 2 SO 4. Tačka topljenja -26,8 ° C, točka ključanja 188,5 ° C. Topivo u alkoholima, loše - u vodi. Reaguje sa amonijakom u odsustvu rastvarača (pri eksploziji); Sumpor nekim aromatičnim jedinjenjima, kao što su esteri fenola. Dobija se interakcijom 60% oleuma sa metanolom na 150 ° C. To je metilaciono sredstvo u organskoj sintezi. Karcinogeni, utiče na oči, kožu, respiratorne organe.
^ Natrijum tiosulfat Na 2 S 2 O 3
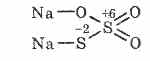
Sol tiosulfurne kiseline u kojoj dva atoma sumpora imaju različita oksidaciona stanja: 6 i -2. Kristalna supstanca, dobro rastvorljiva u vodi. Dostupan u obliku kristalnog Na 2 S 2 O 3 5H 2 O, koji se obično naziva hiposulfit. Dobija se interakcijom natrijum sulfita sa sumporom tokom ključanja:
Na 2 SO 3 S = Na 2 S 2 O 3
Kao i tiosulfurna kiselina, ona je jak redukcioni agens, lako se oksidira sa hlorom u sumpornu kiselinu:
Na 2 S 2 O 3 4Cl 2 5H 2 O = 2H 2 SO 4 2NaCl 6HCl
Upotreba natrijum tiosulfata za apsorpciju hlora (u prvim gasnim maskama) zasnovana je na ovoj reakciji.
Nešto različita oksidacija nastaje slabo oksidirajući agensi natrijum tiosulfata. Ovo formira soli tetrationske kiseline, na primer:
2Na 2 S 2 O 3 I 2 = Na 2 S 4 O 6 2Na
Natrijum tiosulfat je nusprodukt u proizvodnji NaHSO 3, sumpornih boja, u prečišćavanju industrijskih gasova od sumpora. Koristi se za uklanjanje tragova hlora nakon izbeljivanja tkanina, za vađenje srebra iz ruda; je fiksativ u fotografiji, reagens u jodometriji, antidot za trovanje jedinjenjima arsena, živom, antiinflamatornim sredstvom.
Hemijski element sumpor nalazi se u VIA-grupi, u periodu 3 PSCE. Na spoljnjem elektronskom sloju atoma sumpora nalazi se 6 elektrona. Pokazujući svojstva oksidirajućeg agensa u formiranju supstanci sa metalima i vodikom, sumpor stiče oksidacijsko stanje -2 (uzima 2 elektrona).
U sastavu spojeva koji sadrže kiseonik, sumpor pokazuje oksidacijska stanja +4 i +6. Dakle, sumpor se odlikuje oksidacionim stanjima -2; 0; +4; +6.
U prirodi se sumpor nalazi u njegovom prirodnom stanju iu sastavu minerala. Na primer, sumpor sadrži sjaj olova (glavna komponenta je olovni sulfid PbS) i sjaj bakra (glavna komponenta je bakar sulfid Cu 2 S).
Sumpor formira nekoliko jednostavnih supstanci - alotropne modifikacije. Romski sumpor je najstabilniji na sobnoj temperaturi (slika 1). Ova supstanca se sastoji od S8 molekula. Rombični sumpor je žut i topi se na temperaturi od + 112,8 ° C.
Sl. 1. Rombička modifikacija sumpora
Kada se zagreva, rombični sumpor se postepeno pretvara u viskoznu tamno braon masu. Ovo je još jedna alotropna modifikacija sumpora - plastičnog sumpora. Plastični sumpor se sastoji od linearnih molekula sumpora S n.
Sumpor u hemijskim reakcijama sa metalima i vodonikom igra ulogu oksidirajućeg agensa. Njen stepen oksidacije opada od 0 do -2. U reakciji sa kiseonikom, sumpor deluje kao redukciono sredstvo, povećavajući njegov stepen oksidacije od 0 do +4.
Razmotrimo primere interakcija koje uključuju sumpor.
Kada sumpor reagira sa vodikom, formira se sumporovodik:
Kada je cink u interakciji sa sumporom, nastaje cink sulfid:
Sumpor gori u kiseoniku sa formiranjem sumpor oksida (IV) (Slika 2):

Sl. 2. Spaljivanje sumpora u kiseoniku
Razmotrimo svojstva sumpornih jedinjenja sa oksidacionim stanjem "-2". Takva jedinjenja uključuju sumporovodik i sulfide - soli hidrogen sulfidne kiseline.
Vodikov sulfid je plin sa mirisom pokvarenih jaja. Gori u zraku. Štaviše, uz nedostatak i višak kiseonika, sagorijevanje se odvija različito.
U suvišku kisika, vodikov sulfid gori u obliku sumpor oksida (IV) i vode:
2H2S + 3O2 = 2SO2 + 2H2O.
Uz nedostatak kiseonika, dolazi do nepotpunog sagorevanja sumporovodika sa oslobađanjem sumpora: 2H 2 S + O 2 = 2S + 2H 2 O.
Vodikov sulfid je visoko rastvorljiv u vodi. Dobijeni rastvor je slaba kiselina hidrogen sulfida. Soli sumporovodika se nazivaju sulfidi. Hidrofluorna kiselina i vodotopivi sulfidi ulaze u reakcije razmjene.
Interakcija vodonik sulfidne kiseline i bakar (II) klorida formira nerastvorni sulfid bakra (II) i klorovodične kiseline: H 2 S + CuCl 2 = CuS + 2HCl.
Kada je kalijum sulfid u interakciji sa cinkovim nitratom, taloži se cinkov sulfid i formira se kalijum nitrat: K 2 S + Zn (NO 3) 2 = ZnS + 2 KNO 3.
Reference
- Orzhekovsky P.A. Zbirka zadataka i vježbi iz kemije: 9. razred: do udžbenika P.A. Orzhekovsky i drugi. “Hemija. Grade 9 / P.A. Orzhekovsky, N.A. Titov, F.F. Hegel - M.: AST: Astrel, 2007. (str. 91-97)
- Orzhekovsky P.A. Hemija: 9. razred: studije. za opštu sliku. institucija / P.A. Orzhekovsky, L.M. Meshcheryakova, L.S. Pontak - M.: AST: Astrel, 2007. (§ 34)
- Orzhekovsky P.A. Hemija: 9. razred: studije za opšte. institucija / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashov. - M.: Astrel, 2013. (st. 20, 21)
- Rudzitis G.E. Hemija: neorgan. hemija Organ Hemija: studije. za 9 cl. / G.E. Rudzitis, F.G. Feldman. - M.: Obrazovanje, OJSC iz Moskovskih udžbenika, 2009.
- Khomchenko I.D. Zbirka zadataka i vježbi iz kemije za srednju školu. - M.: RIA "Novi val": Izdavač Umerenkov, 2008.
- Enciklopedija za djecu. Volume 17. Chemistry / Chapter. ed. V.A. Volodin, Ved. naučno ed. I. Leenson. - M: Avanta +, 2003.
- Jedna zbirka digitalnih obrazovnih resursa (video iskustva na ovu temu) ().
- Elektronska verzija časopisa "Chemistry and Life" ().
Domaći
- c. 136 No. 3; str.140 №№ 2-4 iz udžbenika P.A. Orzhekovsky "Hemija: 9. razred" / P.A. Orzhekovsky, L.M. Meshcheryakova, M.M. Shalashov. - M: Astrel, 2013.
Sulfidi (od lat. sumpora, sumpora - sumpora)
jedinjenja sumpora sa više elektropozitivnih elemenata; može se smatrati solima hidrogen sulfidne kiseline (Vidi Vodonik sulfidna kiselina) H 2 S. Postoje dva C serije: prosječna (normalna) opće formule M 2 S i kiselina (hidrosulfidi) opće formule MHS, gdje je M monovalentni metal. C. alkalni metali su bezbojni, rastvorljivi u vodi. Njihovi vodeni rastvori su visoko hidrolizovani i alkalni. Pod djelovanjem razrijeđenih kiselina emitiraju H 2 S. C. zemnoalkalni metali su bezbojni, slabo rastvorljivi u vodi. H 2 S se emituje u vlažnom vazduhu, dok su ostale osobine slične S. alkalnim metalima. I oni i drugi S. lako se oksidiraju u sulfate. C. Teški metali su praktično nerastvorljivi u vodi. Skoro svi su crni ili crno-smeđi (osim bijelog ZnS, ružičastog MnS, žutog CdS, narančasto-crvenog Sb 2 S 3, žutog SnS 2). Nejednak odnos C i kiselina i C. amonijaka koristi se u hemijskoj analizi. I.K. Malina.
Velika sovjetska enciklopedija. - M: Sovjetska Enciklopedija. 1969-1978 .
Pogledajte što su "Sulfidi" u drugim rječnicima:
Jedinjenja sumpora sa metalima i nekim nemetalima. Metalni sulfidi su soli hidrogen sulfidne kiseline H2S: srednja (npr. Na2S) i kisela, ili hidrosulfidi (NaHS). Spaljivanjem prirodnih sulfida dobijaju se obojeni metali i SO2. Fosforni sulfidi i ... ... Veliki enciklopedijski rečnik
Modern Encyclopedia
Sulfidi - SULFIDI, neorganski sulfidi sumpornih jedinjenja sa metalima i nekim nemetalima. Uključene u sulfidne rude; koristi se kao fosfor (npr. CdS, ZnS). Molibden sulfid, titanijumsko mazivo. Fosforni sulfidi ... ... Ilustrovani enciklopedijski rečnik
- (novi lat., od lat. sumpor sumpora). Jedinjenja nekog tela sa sumporom, koji odgovaraju oksidima ili kiselinama. Rečnik stranih reči uključen u ruski jezik. Čudinov, AN, 1910. SULFIDI Novolatinsk., Od lat. sumpor, sumpor. Veza ... ... Rečnik stranih riječi ruskog jezika
1. Prirodna sumporna jedinjenja metala i nekih nemetala. U hemiji Odnosi se smatraju solima vodonik sulfidne kiseline H2S. Veliki broj elemenata formira polisulfide sa sumporom, koji su soli polu sumporne kiseline H2Sx. Glavni ... ... Geološka enciklopedija
Sulfidi - - sumporna jedinjenja sa metalima i nekim nemetalima; metalni sulfidi soli vodonik sulfidne kiseline H2S. Terminološki rječnik za beton i armirani beton. FSU “SIC“ Izgradnja ”NIIZHB i stanica metroa A. A. Gvozdeva, Moskva, 2007. 110 str.] ...… Enciklopedija termina, definicija i objašnjenja građevinskog materijala
SULPHES, s, u sulfid, a, muž (spec.) Hemijski spojevi sumpora sa metalima i određenim nemetalima. Organic with Natural s. | adj sulfid, oh, oh. Rječnik ozhegova. S.I. Ozhegov, N.Yu. Shvedov. 1949 1992 ... Rječnik ozhegova
Sulfidi, R2S (R aromatski radikal), najlakše se dobijaju dodavanjem kap po kap otopine diazo soli na 60 ... Enciklopedija Brockhaus i Efron
SULFIDES - (1) u neorganskoj hemiji, takva jedinjenja sa sumporom, u kojima atomi sumpora imaju oksidaciono stanje 2. U hemijskom. odnose se na soli slabe hidrogen sulfidne kiseline (vodeni rastvor H2S). Mnogi S. su prirodni ... ... Velika Politehnička Enciklopedija
Oh; mn (jedinice sulfid, i; m.). [od lat. sumpor sumpor] Chem. Jedinjenja sumpora sa metalima i nekim nemetalima. C. titanium. Organic with Natural s. (klasa minerala). Ide Sulfid, th, oh. Sa mešanim smešama. Od rude rude. * * * sulfidi jedinjenja sumpora ... Enciklopedijski rečnik
- (iz latinskog sumpornog sumpora) klasa hemijskih jedinjenja koja su jedinjenja metala (kao i niz nemetala B, Si, P, As) sa sumporom (S), gde ima oksidaciono stanje od -2. Može se smatrati solima hidrogen sulfida ... ... Wikipedia
Books
- Uranijumski depoziti kao što su neslaganje u fanerozoiku, Andrej Borisovič Khalezov. Karakteristike uranovih naslaga u strukturama riječne paleo-doline na površinama strukturnog i stratigrafskog neslaganja razmatraju se na primjeru tri regije Uralske regije s različitim ...
Sumpor - Element trećeg perioda i VIA grupa Periodnog sistema, serijski broj 16, odnosi se na halcogens. Elektronska formula atoma [10 Ne] 3s 2 3p 4, karakteristična oksidaciona stanja 0, -II, + IV i + VI, stanje S VI se smatra stabilnim.
Skala oksidacije sumpora:
Elektronegativnost sumpora je 2,60, karakteriše je nemetalna svojstva. Kod vodonika i kiseonika sadrži različite anione, formira kiseline koje sadrže kiseonik i njihove soli, binarna jedinjenja.
U prirodi - petnaesti element hemijske prevalencije (sedmi među nemetalima). Nalazi se u slobodnom (izvornom) i srodnom obliku. Vitalni element za više organizme.
Sulphur S. Jednostavna supstanca. Kristalno žuta (α-rombična i β-monoklinska,
na 95,5 ° C) ili amorfni (plastični). U rešetkama postoje S8 molekule (ne-planarni "corona" ciklusi), amorfni sumpor se sastoji od S n lanaca. Tvar koja slabo topi, viskoznost tečnosti prolazi kroz maksimum na 200 ° C (razmak molekula S 8, isprepletanje lanaca S n) U paru - molekuli S 8, S 6, S 4, S 2. Na 1500 ° C, pojavljuje se monoatomski sumpor (u hemijskim jednačinama za jednostavnost, svaki sumpor je predstavljen kao S).
Sumpor se ne otapa u vodi i pod normalnim uvjetima ne reagira s njim, dobro je topljiv u ugljikovom disulfidu CS 2.
Sumpor, naročito u prahu, ima visoku aktivnost kada se zagreva. Reaguje kao oksidacioni agens sa metalima i nemetalima:
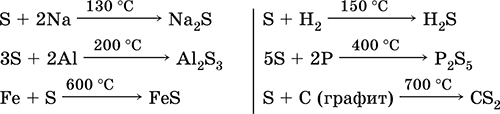
o čemu redukcijski agens - s fluorom, kisikom i kiselinama (pri ključanju):
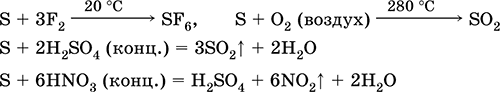
Sumpor se podvrgava dismutaciji u alkalnim rastvorima:
3S 0 + 6KOH (konc.) = 2K 2 S-II + K 2 S IV O 3 + 3H 2 O
Na visokim temperaturama (400 ° C) sumpor zamjenjuje jod iz jodida vodika:
S + 2NI (g) = I 2 + H 2 S,
ali u rešenju reakcija ide suprotno:
I 2 + H 2 S (p) = 2 HI + S ↓
Getting: in industrija topi se iz prirodnih naslaga prirodnog sumpora (koristeći vodenu paru), koji se oslobađa prilikom desumporizacije proizvoda za gasifikaciju uglja.
Sumpor se koristi za sintezu disulfidne, sumporne, sumporne (vat) boje, u vulkanizaciji gume, kao sredstva za zaštitu biljaka od pepelnice, i za lečenje kožnih bolesti.
Vodikov sulfid H 2 S. Kisik bez kisika. Bezbojni plin sa zagušljivim mirisom, teži od zraka. Molekul ima strukturu dvostruko nekompletnog tetraedra [:: S (H) 2]
(sp 3 - hibridizacija, ugao H - S - H je daleko od tetraedarske). Nestabilan pri zagrevanju iznad 400 ° C. Slabo je rastvorljiv u vodi (2,6 l / 1 l H2O na 20 ° C), zasićeni rastvor je decimolaran (0,1 M, „vodonik sulfid voda“). Veoma slaba kiselina u rastvoru praktično ne disocira u drugoj fazi na S 2 - ione (maksimalna koncentracija S 2 -1 je jednaka 1 10 –13 mol / l). Kada stoji na zraku, otopina postaje mutna (inhibitor - saharoza). Neutralizira se alkalijama, a ne potpuno - hidratom amonijaka. Snažno sredstvo za redukciju. On ulazi u reakcije ionske izmjene. Sredstvo za sulfidiranje, taloži se iz otopine različito obojenih sulfida s vrlo niskom topljivošću.
Kvalitativne reakcije - sedimentacija sulfida, kao i nepotpuno sagorijevanje H 2 S uz formiranje žutog naslaga sumpora na hladnom objektu koji se unosi u plamen (porcelanska lopatica). Nusprodukt prerade nafte, prirodnog i koksnog gasa.
Koristi se u proizvodnji sumpornih, neorganskih i organskih jedinjenja koja sadrže sumpor kao analitički reagens. Izuzetno otrovno. Jednačine najvažnijih reakcija:
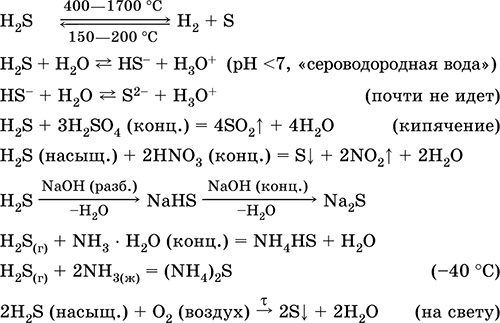

Getting: in industrija - direktna sinteza:
H 2 + S = H 2 S(150–200 ° C)
ili zagrijavanjem sumpora parafinom;
u laboratorije - istiskivanje sulfida jakim kiselinama
FeS + 2NCl (konc.) = FeCl 2 + H 2 S
ili kompletna hidroliza binarnih jedinjenja:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 3 + 3 H 2 S
Natrijum sulfid Na 2 S. Sol bez kisika. Bijela, vrlo higroskopna. Topi se bez raspadanja, termički stabilan. Dobro je rastvorljiv u vodi, hidroliziran anionom, stvara visoko alkalni medij u rastvoru. Kada stoji na zraku, otopina postaje mutna (koloidni sumpor) i postaje žuta (polisulfidna boja). Tipično redukciono sredstvo. Pridaje sumpor. On ulazi u reakcije ionske izmjene.
Kvalitativne reakcije na ionskim S 2– - taloženju različito obojenih metalnih sulfida, od kojih se MnS, FeS, ZnS razlažu na HCl (s).
Koristi se u proizvodnji sumpornih boja i celuloze, za uklanjanje dlake kože tokom štavljenja kože, kao reagens u analitičkoj hemiji.
Jednačine najvažnijih reakcija:
Na 2 S + 2NCl (dec.) = 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (konc.) = SO 2 + S 2 + 2H 2 O + 2NaHSO 4 (do 50 ° C)
Na 2 S + 4HNO 3 (konc.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (sat.) = 2NaHS
Na 2 S (t) + 2O 2 = Na 2 SO 4 (iznad 400 ° C)
Na2S + 4H2O2 (konc.) = Na2S04 + 4H2O
S 2– + M 2+ = MnS (kaplar) ↓; FeS (crna) ↓; ZnS (bijeli)
S 2‑ + 2Ag + = Ag 2 S (crno)
S 2– + M 2+ = CdS (žuta) ↓; PbS, CuS, HgS (crno)
3S 2‑ + 2Bi 3+ = Bi 2 S 3 (crno))
3S 2‑ + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
Getting u industrija - kalcinacija minerala mirabilite Na 2 SO 4 10H 2 O u prisustvu redukcionih sredstava:
Na 2 SO 4 + 4H 2 = Na 2 S + 4 H 2 O (500 ° C, kat. Fe 2 O 3)
Na 2 SO 4 + 4C (koks) = Na 2 S + 4CO (800–1000 ° C)
Na 2 SO 4 + 4CO = Na 2 S + 4SO 2 (600–700 ° C)
Aluminijev sulfid Al 2 S 3. Sol bez kisika. Bela, veza Al - S je pretežno kovalentna. Topi se bez raspadanja pod prekomjernim tlakom N 2, lako se sublimira. Kod kalcinacije se oksidira u zraku. Potpuno hidrolizovan sa vodom, ne istaloži se iz rastvora. Raspadanjem jakih kiselina. Koristi se kao čvrsti izvor čistog hidrogen sulfida. Jednačine najvažnijih reakcija:
Al 2 S 3 + 6H 2 O = 2Al (OH) 3 3 + 3H 2 S (čisto)
Al 2 S 3 + 6NCl (dec.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24 HNO 3 (konc.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (zrak) = 2Al 2 O 3 + 6SO 2 (700–800 ° C)
Getting: interakcija aluminija sa rastaljenim sumporom u odsustvu kiseonika i vlage:
2Al + 3S = AL 2 S 3(150–200 ° C)
Željezo (II) sulfid FeS. Sol bez kisika. Crna i siva sa zelenom nijansom, vatrostalne, razgrađuje se pri zagrijavanju u vakuumu. U mokrom stanju je osjetljivo na kisik u zraku. Nerastvorljiv u vodi. Ne taloži se zasićenjem otopina soli željeza (II) sa sumporovodikom. Razgrađena kiselinama. Koristi se kao sirovina u proizvodnji željeza, čvrstog izvora vodikovog sulfida.
Sastav željeznog (III) sastava Fe 2 S 3 nije poznat (nije primljen).
Jednačine najvažnijih reakcija:
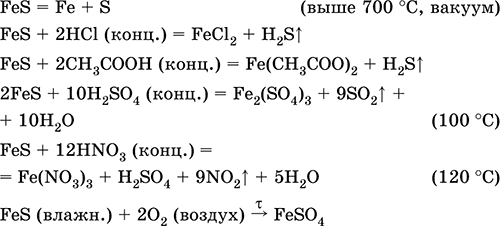
Primanje:
Fe + S = Fes (600 ° C) \\ t
Fe 2 O 3 + H 2 + 2 H 2 S = 9 Fes + 3H 2 O (700-1000 ° C)
FeCl 2 + 2NH 4 HS (g) = Fes 2 + 2NH 4 Cl + H 2 S
Željezni disulfid FeS 2. Binarna veza. Ima ionsku strukturu Fe 2+ (–S - S–) 2 -. Tamno žuta, termički stabilna, razgrađuje se pri paljenju. Nerastvorljiv u vodi, ne reaguje sa razblaženim kiselinama, alkalijama. Razgrađuje se sredstvima za oksidaciju kiseline, pržena u zraku. Koristi se kao sirovina u proizvodnji željeza, sumpora i sumporne kiseline, katalizatora u organskoj sintezi. U prirodi - rudni minerali pirit i marcasite.
Jednačine najvažnijih reakcija:
FeS 2 = FeS + S (iznad 1170 ° C, vakuum)
2FeS 2 + 14H 2 SO 4 (konc., Planine) = Fe 2 (SO 4) 3 + 15SO 2 + 14N 2 O
FeS 2 + 18HNO 3 (konc.) = Fe (NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (zrak) = 8SO 2 + 2Fe 2 O 3 (800 ° C, pečenje)
Amonijev hidrosulfid NH 4 HS. Sol kisika bez kisika. Bijeli, rastopljen pod pritiskom. Izuzetno nestabilan, termički nestabilan. On oksidira na zraku. Dobro je rastvorljiv u vodi, hidroliziran kationom i anionom (prevladava), stvara alkalno okruženje. Rastvor postaje žut u vazduhu. Razgrađuje se kiselinama, u zasićenom rastvoru dodaje se sumpor. Alkali se ne neutrališu, srednja so (NH 4) 2 S ne postoji u rastvoru (za uslove dobijanja srednje soli, vidi naslov "H 2 S"). Koristi se kao komponenta foto developera, kao analitički reagens (sulfidni precipitator).
Jednačine najvažnijih reakcija:
NH 4 HS = NH 3 + H 2 S (iznad 20 ° C)
NH 4 HS + HCl (dec.) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (konc.) = S 2 + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (sat. H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2 CuS
Getting: zasićenje koncentriranog rastvora NH 3 sa sumporovodikom:
NH3H2O (konc.) + H 2 S (g) = NH 4 HS + H 2 O
U analitičkoj kemiji, otopina koja sadrži jednake količine NH 4 HS i NH 3 H 2 O konvencionalno se smatra rješenjem (NH4) 2S, a prosječna formula soli se koristi u pisanju jednadžbi reakcije, iako je amonijev sulfid potpuno hidroliziran u vodi do NH 4 HS i NH 3 H 2 O.
Sumpor dioksid. Sulfites
Sumpor dioksid SO 2. Acid oxide. Bezbojni plin sa oštrim mirisom. Molekul ima strukturu nekompletnog trokuta [: S (O) 2] (sp2 - hibridizacija), sadrži σ, π - veze S = O. Lako ukapljen, termički stabilan. Topiva je u vodi (~ 40 l / 1 l H 2 O na 20 ° C). Formira polihidrat sa svojstvima slabe kiseline, proizvodi disocijacije - joni HSO 3 - i SO 3 2 -. Ion HSO 3 - ima dva tautomerna oblika - simetrično (bezkiselinski) sa strukturom tetraedra (sp3 - hibridizacija), koji prevladava u smeši, i asimetričan (kisela) sa strukturom nekompletnog tetraedrona [: S (O) 2 (OH)] (sp3 - hibridizacija). Ion SO 3 2- je također tetraedarski [: S (O) 3].
Reaguje sa alkalijama, amonijum hidratom. Tipično redukciono sredstvo, slabo oksidaciono sredstvo.
Kvalitativna reakcija - obezbojenje žuto-smeđe "jodne vode". Srednji proizvod u proizvodnji sulfita i sumporne kiseline.
Koristi se za izbjeljivanje vune, svile i slame, čuvanje i čuvanje voća, kao dezinfekcijsko sredstvo, antioksidans, rashladno sredstvo. Otrovno.
Jedinjenje H 2 SO 3 (sumporne kiseline) nije poznato (ne postoji).
Jednačine najvažnijih reakcija:
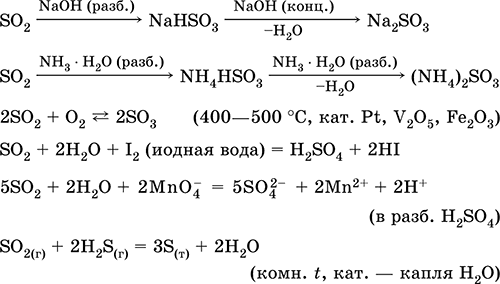
Otapanje u vodi i kiselim svojstvima:
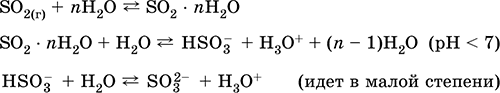
Getting: u industriji - sagorijevanje sumpora u zraku obogaćenom kisikom i, u manjoj mjeri, pečenje sulfidnih ruda (SO 2 - pridruženi plin za vrijeme pečenja pirita):
S + O 2 = SO 2(280–360 ° C)
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8 SO 2(800 ° C, pečenje)
u laboratoriji - istiskivanje sulfita sumpornom kiselinom:
BaSO 3 (t) + H2SO4 (konc.) = BaSO4 + SO2 + H20
Natrijum sulfit Na 2 SO 3. Saline White Kada se zagrijava u zraku, razgrađuje se bez topljenja, topi se pod argonom nadpritiskom. U mokrom stanju iu rastvoru osjetljivom na kisik u zraku. Topiva je u vodi, hidrolizovana anionom. Razgrađena kiselinama. Tipično redukciono sredstvo.
Kvalitativna reakcija na ion SO 3 2 - formiranje belog taloga barijum sulfita, koji se prenosi u rastvor jakim kiselinama (HCl, HNO 3).
Koristi se kao reagens u analitičkoj hemiji, komponenti fotografskih rješenja, neutralizatoru klora u izbjeljivanju tkanina.
Jednačine najvažnijih reakcija:
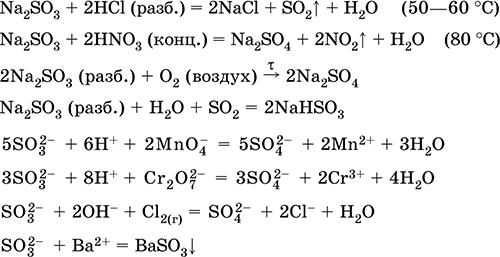
Primanje:
Na 2 CO 3 (konc.) + SO 2 = Na 2 SO 3 + CO 2
Sumporna kiselina. Sulfati
Sumporna kiselina H 2 SO 4. Oksična kiselina. Bezbojna tekućina, vrlo viskozna (masna), vrlo higroskopna. Molekul ima iskrivljenu tetraedarnu strukturu (sp 3 gib hibridizacija), sadrži kovalentne σ - veze S - OH i σπ - veze S = O. Ion SO 4 2- ima ispravno tetraedarnu strukturu. Ima širok temperaturni opseg tečnog stanja (~ 300 stepeni). Prilikom zagrijavanja iznad 296 ° C djelomično se raspada. Destilira se kao azeotropna smjesa s vodom (maseni udio kiseline je 98,3%, vrelište je 296–340 ° C), potpuno se razgrađuje s jačim zagrijavanjem. Neograničeno mešanje sa vodom (sa jakim exo-Effect). Jaka kiselina u rastvoru, neutralizirana alkalijama i amonijakom hidratom. Pretvara metale u sulfate (sa suviškom koncentrirane kiseline u normalnim uvjetima, formiraju se topivi hidrosulfati), ali Be, Bi, Co, Fe, Mg i Nb metali se pasiviziraju u koncentriranoj kiselini i ne reagiraju s njim. Reaguje sa osnovnim oksidima i hidroksidima, razlaže soli slabih kiselina. Slab oksidans u razblaženom rastvoru (zbog H I), jak - u koncentriranom rastvoru (zbog S VI). Dobro rastvara SO 3 i reagira s njim (stvara se teška uljasta tekućina - oleum sadrži H 2 S 2 O 7).
Kvalitativna reakcija na SO 4 2 - ion - taloženje bijelog barijevog sulfata BaSO 4 (talog se ne pretvara u otopinu klorovodične i dušične kiseline, za razliku od bijelog taloga BaSO 3).
Koristi se u proizvodnji sulfata i drugih sumpornih jedinjenja, mineralnih đubriva, eksploziva, boja i lekova, u organskoj sintezi, za „otvaranje“ (prva faza prerade) industrijski važnih ruda i minerala, u rafinaciji naftnih proizvoda, elektrolizi vode, kao elektrolitu olovnih baterija . Otrovan, izaziva opekotine kože. Jednačine najvažnijih reakcija:
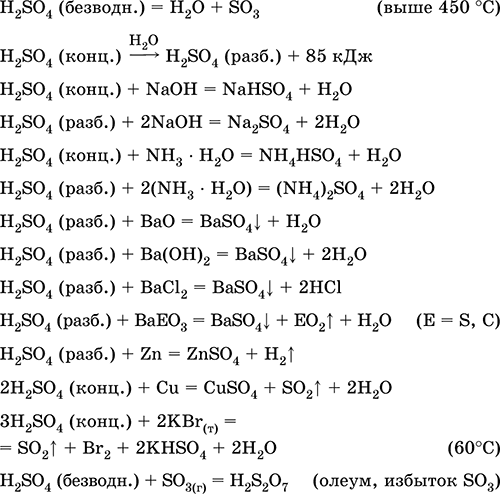
Getting u industrija:
a) sinteza SO 2 iz sumpora, sulfidnih ruda, sumporovodika i sulfatnih ruda:
S + O 2 (zrak) = SO 2(280–360 ° C)
4FeS 2 + 11O 2 (zrak) = 8 SO 2 + 2Fe 2 O 3 (800 ° C, pečenje)
2H2S + 3O2 (g) = 2 SO 2 + 2H 2 O (250–300 ° C)
CaSO 4 + S (koks) = CaO + SO 2 + CO (1300–1500 ° C)
b) konverziju SO 2 u SO 3 u kontaktni aparat:
c) sinteza koncentrovane i bezvodne sumporne kiseline:
H 2 O (Zbir H 2 SO 4) + SO 3 = H 2 SO 4(konc., anhid.)
(apsorpcija SO3 čistom vodom uz proizvodnju H 2 SO 4 se ne provodi zbog jakog zagrijavanja smjese i obrnute dekompozicije H2S04, vidi gore);
d) sinteza oleum - mješavina bezvodnog H2S04, disarične kiseline H 2 S 2 O 7 i suviška SO3. Rastvoreni SO 3 osigurava bezvodnost oleuma (H 2 SO 4 se odmah formira kada voda ulazi), što omogućava da se sigurno transportuje u čeličnim spremnicima.
Natrijum sulfat Na 2 SO 4. Saline Bijela, higroskopna. Topi se i ključa bez raspadanja. Oblikuje kristalni hidrat (mineral mirabilite) lako gubi vodu; tehničko ime Glauberova sol. Topiv je u vodi, a ne hidroliziran. Reaguje sa H2S04 (konc.), SO3. Obnavljanje vodikom, koks kada se zagrijava. On ulazi u reakcije ionske izmjene.
Koristi se u proizvodnji stakla, celuloznih i mineralnih boja, kao lijek. Sadržana u slanoj vodi soli, posebno u zaljevu Kara-Bogaz-Gol Kaspijskog mora.
Jednačine najvažnijih reakcija:
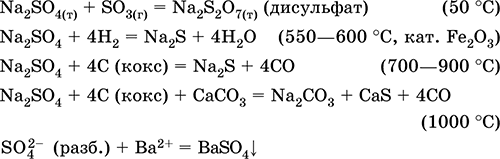
Kalijev hidrosulfat KHSO 4. Kiselu oksolnu sol. Bijela, higroskopna, ali ne stvara kristalne hidrate. Kada se zagrijava topi se i raspada. Dobro je rastvorljiv u vodi, anion se podvrgava disocijaciji u rastvoru, medij za rastvor je jako kiselinski. Neutralizira se alkalijama.
Koristi se kao sastojak fluksa u metalurgiji, sastavni dio mineralnih đubriva.
Jednačine najvažnijih reakcija:
2KHSO 4 = K 2 SO 4 + H 2 SO 4 (do 240 ° C)
2KHSO 4 = K 2 S 2 O 7 + H 2 O (320–340 ° C)
KHSO 4 (razr.) + KOH (konc.) = K 2 SO 4 + H 2 O KHSO 4 + KCl = K 2 SO 4 + HCl (450–700 ° C)
6KHSO 4 + M 2 O 3 = 2KM (SO 4) 2 + 2K 2 SO 4 + 3H 2 O (350–500 ° C, M = Al, Cr)
Getting: tretiranje kalijum sulfata u hladnoj (sa više od 6O%) sumporne kiseline
K 2 SO 4 + H 2 SO 4 (konc.) = 2 KHSO 4
Kalcijum sulfat CaSO 4. Saline Bijela, vrlo higroskopna, vatrostalna, raspada se pri kalcinaciji. Prirodni CaSO 4 se nalazi u obliku vrlo čestog minerala gips CaSO 4 2H 2 O. Na 130 ° C gips gubi dio vode i ulazi u vodu spaljena žbuka2CaSO 4 H 2 O (tehnički naziv alabaster). Potpuno dehidrirani (200 ° C) gips odgovara na mineral anhidritCaSO 4. Slabo rastvorljiv u vodi (0,206 g / 100 g H 2 O na 20 ° C), rastvorljivost se smanjuje pri zagrevanju. Reaguje sa H2S04 (konc.). Obnavlja se koksom tokom fuzije. Definiše većinu "konstantne" tvrdoće slatke vode (za više detalja, vidi 9.2).
Jednačine najvažnijih reakcija: 100–128 ° C
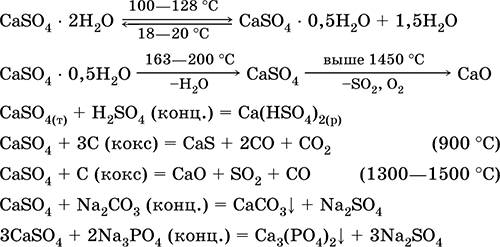
Koristi se kao sirovina u proizvodnji SO 2, H 2 SO 4 i (NH 4) 2 SO 4, kao fluks u metalurgiji, punila za papir. Vezujući malter pripremljen od spaljenog gipsanog „kompleta“ brže je nego smjesa na bazi Ca (OH) 2. Stvrdnjavanje se vrši vezivanjem vode, formiranjem gipsa u obliku kamene mase. Spaljeni gips se koristi za izradu gipsanih odljeva, arhitektonskih i dekorativnih oblika i proizvoda, pregradnih zidova i panela i kamenih podova.
Aluminijum kalijum sulfat KAl (SO 4) 2. Dvostruka oksolna sol. Bijela, higroskopna. S jakom toplinom razlaže se. Oblikuje kristalni hidrat - alumina kalijum alum. Umereno rastvorljiv u vodi, hidrolizovan aluminijumskim katjonom. Reaguje sa alkalijama, amonijum hidratom.
Koristi se kao sredstvo za bojanje tkanina, štavljenje kože, koagulant u pročišćavanju slatke vode, sastavni dio kompozicija za dimenzioniranje papira i vanjski hemostatični agens u medicini i kozmetologiji. Nastaje ko-kristalizacijom aluminijuma i kalijum sulfata.
Jednačine najvažnijih reakcija:
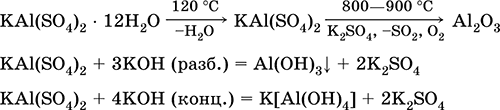
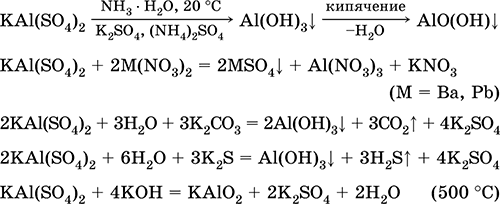
Hrom (III) sulfat - kalijum KCr (SO 4) 2. Dvostruka oksolna sol. Crveno (tamno ljubičasti hidrat, tehničko ime kalijev aluminij). Kada se zagreva razgrađuje bez topljenja. Lako se rastvara u vodi (sivo-plava boja otopine odgovara aquacomplexu 3+), hidrolizira krom (III). Reaguje sa alkalijama, amonijum hidratom. Slab oksidans i redukcijski agens. On ulazi u reakcije ionske izmjene.
Kvalitativne reakcije do Cr 3+ iona - redukcija do Cr 2+ ili oksidacija do žutog CrO 4 2-.
Koristi se kao sredstvo za štavljenje kože, sredstvo za bojenje tkanina, reagens na fotografiji. Nastaje ko-kristalizacijom hroma (III) i kalijum sulfata. Jednačine najvažnijih reakcija:
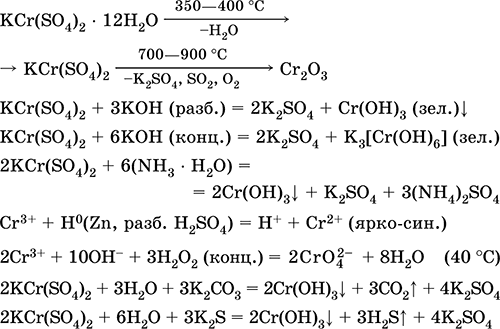
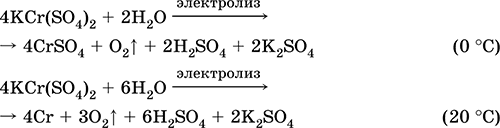
Mangan (II) sulfat MnSO 4. Saline Bijelo, kad se kalcinira, topi se i razgrađuje. Kristalni hidrat MnSO 4 5H 2 O - crveno - roze, tehnički naziv mangan vitriol. Topiva je u vodi, svijetlo ružičasta (gotovo bezbojna) boja otopine odgovara vodenom kompleksu 2+; hidrolizovan kationom. Reaguje sa alkalijama, amonijum hidratom. Slab reduktivni agens reaguje sa tipičnim (jakim) oksidirajućim agensima.
Kvalitativne reakcije na ion Mn2 + - provodljivost sa ionom MnO 4 i nestajanje ljubičaste boje potonjeg, oksidacija Mn 2+ u MnO 4, i pojavljivanje ljubičaste boje.
Koristi se za dobijanje Mn, MnO 2 i drugih spojeva mangana, kao mikronutrijente i analitičke reagense.
Jednačine najvažnijih reakcija:
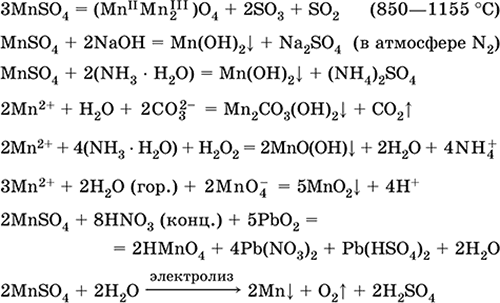
Primanje:
2MnO 2 + 2H 2 SO 4 (konc.) = 2 MnSO 4 + O 2 + 2H 2 O (100 ° C)
Željezo (II) sulfat FeSO 4. Saline Bela (hidrat svetlo zelena, tehničko ime željezni vitriol),higroskopan. Raspada se pri zagrijavanju. Topljiv je u vodi, u maloj mjeri hidroliziran kationom. Brzo se oksidira u rastvoru kisikom u zraku (otopina postaje žuta i postaje mutna). Reaguje sa sredstvima za oksidaciju kiseline, alkalijama, amonijakom. Tipično redukciono sredstvo.
Koristi se kao sastojak mineralnih boja, elektrolita u galvanizaciji, drvenog konzervansa, fungicida, anti-anemijskog lijeka. U laboratoriji se češće uzima kao dvostruka sol Fe (NH 4) 2 (SO 4) 2 6N 2 O ( salt mora) otporniji na zrak.
Jednačine najvažnijih reakcija:
![]()
Primanje:
Fe + H 2 SO 4 (dec.) = FeSO 4+ H 2
FeCO 3 + H 2 SO 4 (par.) = FeSO 4 + CO 2 + H 2 O
7.4. VA-grupa ne-metala
Azot Amonijak
Azot - element 2. perioda i VA - grupa Periodnog sistema, serijski broj 7. Atomska elektronska formula [2 He] 2s 2 2p 3, karakteristična oksidaciona stanja 0, –III, + III i + V, rjeđe + II, + IV i drugi; N v stanje se smatra relativno stabilnim.
Skala oksidacije azota:
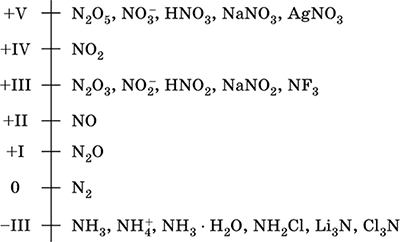
Azot ima visoku elektronegativnost (3.07), treći nakon F i O. Prikazuje tipična nemetalna (kisela) svojstva. Formira različite kiseline, soli i binarna jedinjenja koja sadrže kiseonik, kao i amonijum kation NH 4 + i njegove soli.
U prirodi - sedamnaesti element hemijske prevalencije (deveti među nemetalima). Vitalni element za sve organizme.
Dušik N 2. Jednostavna supstanca. Sastoji se od nepolarnih molekula sa veoma stabilnom σππ - vezom N, N, što objašnjava hemijsku inertnost azota u normalnim uslovima. Bezbojni plin bez mirisa koji se kondenzira u bezbojnu tekućinu (za razliku od O 2).
Glavna komponenta vazduha: 78.09% po zapremini, 75.52% po masi. Iz tečnog vazduha, azot kipi iznad kiseonika O2. Slabo je rastvorljiv u vodi (15.4 ml / 1 l H 2 O na 20 ° C), rastvorljivost azota je manja od rastvorljivosti kiseonika.
Na sobnoj temperaturi, N 2 reaguje samo sa litijumom (u vlažnoj atmosferi), formirajući litijum nitrid Li 3 N, nitridi drugih elemenata sintetizirani su sa jakim zagrevanjem:
N 2 + 3Mg = Mg 3 N 2 (800 ° C)
U električnom pražnjenju, N 2 reagira s fluorom i u vrlo maloj mjeri s kisikom:
Reverzibilna reakcija za proizvodnju amonijaka odvija se na 500 ° C, pod tlakom do 350 atm i nužno u prisustvu katalizatora (Fe / F 2 O 3 / FeO, u Pt laboratoriji):
U skladu sa Le Chatelier principom, povećanje prinosa amonijaka treba da se dogodi sa povećanjem pritiska i smanjenjem temperature. Međutim, brzina reakcije na niskim temperaturama je vrlo niska, tako da se proces provodi na 450-500 ° C, postižući 15% prinos amonijaka. Nereagirani N 2 i H 2 se vraćaju u reaktor i time povećavaju stupanj reakcije.
Azot je hemijski pasivan u odnosu na kiseline i baze, ne podržava sagorevanje.
Getting u industrija - frakcionom destilacijom tečnog vazduha ili uklanjanjem kiseonika iz vazduha hemijskim sredstvima, na primer, reakcijom 2C (koks) + O 2 = 2CO zagrevanjem. U ovim slučajevima proizvodi se azot, koji takođe sadrži nečistoće plemenitih gasova (uglavnom argona).
In laboratorije male količine hemijski čistog azota mogu se dobiti reakcijom kombinacije sa umjerenim zagrijavanjem:
N –III H 4 N III O 2 (t) = N 2 0 + 2 H 2 O (60–70 ° C)
NH 4 Cl (p) + KNO 2 (p) = N 2 0 + KCl + 2 H 2 O (100 ° C)
Koristi se za sintezu amonijaka, azotne kiseline i drugih proizvoda koji sadrže azot, kao inertno okruženje za hemijske i metalurške procese i skladištenje zapaljivih supstanci.
Amonijak NH 3. Binarno jedinjenje, stepen oksidacije azota je - III. Bezbojni plin sa oštrim karakterističnim mirisom. Molekul ima strukturu nekompletnog tetraedrona [: N (H) 3)] (sp 3 gib-hibridizacija). Prisustvo azota u molekulu NH 3 para donora elektrona u sp3 - hibridnoj orbitalni uzrokuje karakterističnu reakciju dodavanja kationa vodonika, sa formiranjem kationa amonijum NH 4 +. Ukapljen pod pritiskom na sobnoj temperaturi. U tekućem stanju je povezano zbog vodikovih veza. Termički nestabilan. Topiva je u vodi (više od 700 l / 1 l H 2 O na 20 ° C); proporcija u zasićenom rastvoru je = 34% po masi i = 99% po zapremini, pH = 11,8.
Veoma reaktivan, sklon reakcijama dodavanja. Nastaje u kiseoniku, reaguje sa kiselinama. Ima svojstva redukcije (zbog N-III) i oksidirajućih (zbog H I) svojstava. Isušuje se samo sa kalcijum oksidom.
Kvalitativne reakcije - formiranje bijelog "dima" u dodiru s plinovitim HCl, pocrnjenje papira navlaženog otopinom Hg 2 (NO 3) 2.
Međuproizvod u sintezi HNO 3 i amonijevih soli. Koristi se u proizvodnji sode, azotnih đubriva, bojila, eksploziva; Tečni amonijak je rashladno sredstvo. Otrovno.
Jednačine najvažnijih reakcija:
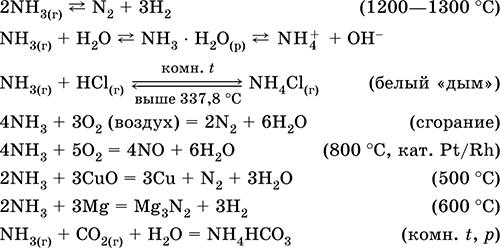
Getting: in laboratorije - premještanje amonijaka iz amonijevih soli pri zagrijavanju soda (NaOH + CaO):
ili ključanjem vodenog rastvora amonijaka, nakon čega slijedi sušenje plina.
In industrija amonijak se sintetizira iz dušika (vidi) sa vodikom. Proizvedena u industriji u tečnom obliku ili u obliku koncentriranog vodenog rastvora pod tehničkim nazivom amonijačna voda.
Hidrat amonijaka NH3H2O. Intermolecular compound. Bijela, u kristalnoj rešetki su NH 3 i H 2 O molekuli, vezani slabom vodikovom vezom H 3 N ... HON. Prisutan u vodenom rastvoru amonijaka, slaba baza (proizvodi disocijacije - kation NH 4 - i anion OH -). Amonijev kation ima redovito π-tetraedarnu strukturu (sp3 - hibridizacija). Termički nestabilna, potpuno razgrađena ključanjem otopine. Neutralizirano jakim kiselinama. Prikazuje redukcione osobine (zbog N III) u koncentriranom rastvoru. On ulazi u reakciju ionske izmjene i kompleksacije.
Kvalitativna reakcija - formiranje bijelog "dima" u dodiru s plinovitim HCl.
Koristi se za stvaranje slabog alkalnog medija u otopini, za vrijeme taloženja amfoternih hidroksida.
1M otopina amonijaka sadrži uglavnom NH3H20 hidrat i samo 0,4% NH4 + i OH - iona (zbog disocijacije hidrata); tako, ionski “amonijum hidroksid NH4OH” praktično nije sadržan u rastvoru, ne postoji takvo jedinjenje u čvrstom hidratu. Jednačine najvažnijih reakcija:
NH3H2O (konc.) = NH 3 + H 2 O (ključanje sa NaOH)
NH3H2O + HCl (dec.) = NH 4 Cl + H 2 O
3 (NH3H2O) (konc.) + CrCl 3 = Cr (OH) 3 3 + 3NH 4 Cl
8 (NH3H2O) (konc.) + ZB 2 (p) = N 2 + 6 NH 4 Br + 8 H 2 O (40–50 ° C)
2 (NH3H2O) (konc.) + 2KMnO 4 = N 2 + 2MnO 2 4 + 4H 2 O + 2KON
4 (NH3H2O) (konc.) + Ag 2 O = 2OH + 3H2O
4 (NH3H2O) (konc.) + Cu (OH) 2 + (OH) 2 + 4H 2 O
6 (NH3H2O) (konc.) + NiCl 2 = Cl 2 + 6H 2 O
Često se naziva razblažena otopina amonijaka (3-10% vremena) tečni amonijak (ime su izmislili alkemičari) i koncentrovani rastvor (18,5–25%) amonijačna voda (proizvodi industrija).
