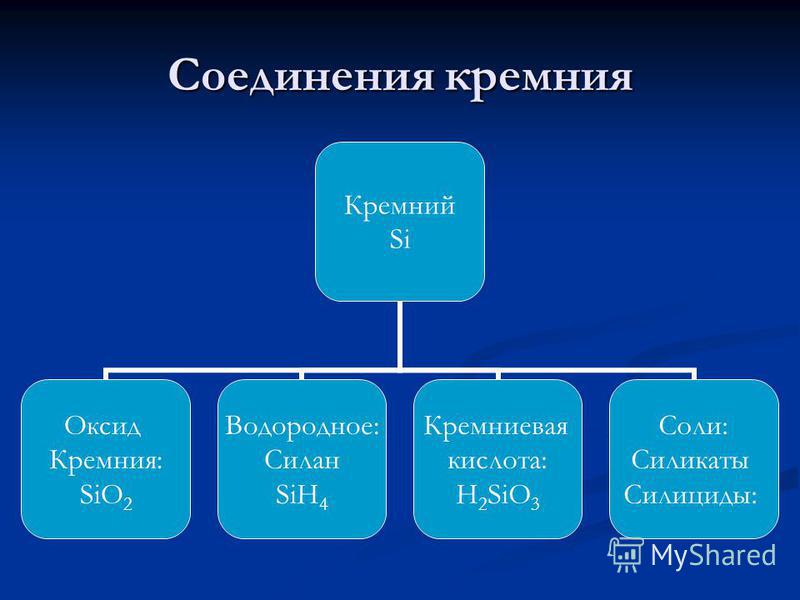
Цахиурын бүтцийн диаграмм. Электрон бүрхүүлийн бүтэц
Атомын бүтэц PS дахь байр суурь: III үе; IV бүлэг, толгойлсон; Үндсэн төлбөр: +14 Si; Харьцангуй атомын масс: Ar (Si) \u003d 28 Атомын бүтэц: p \u003d 14, e \u003d 14, n \u003d \u003d 14 Цахим томъёо: +14 Si 2e; 8e; 4e; +14 Si 1s 2 2s 2 2p 6 3s 2 3p Si 1s 2 2s 2 2p 6 3s 2 3p 2 Металл бус;
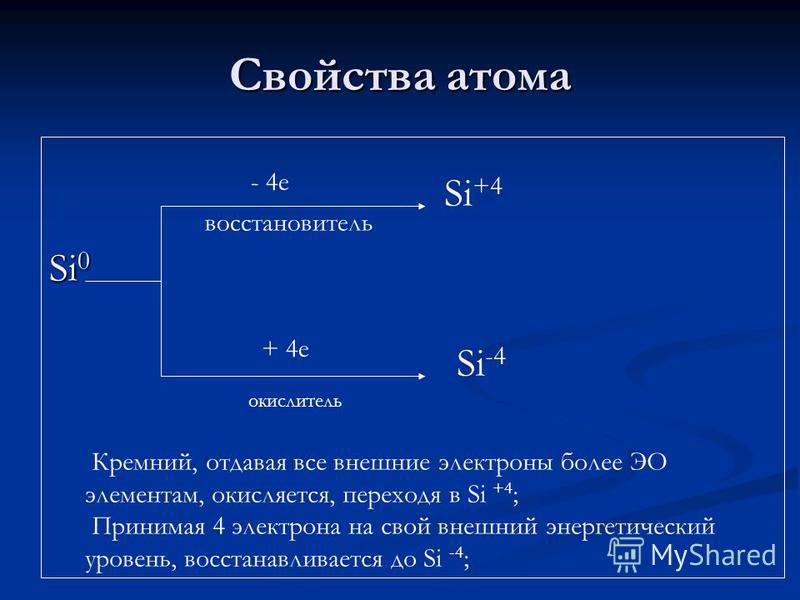
Атомын шинж чанар Si e бууруулах агент + 4 e исэлдүүлэгч бодис Si +4 Si -4 Цахиур, бүх гадаад электроныг EO элементээс их хэмжээгээр өгч, исэлдэж, Si +4 руу дамждаг; 4 электроныг гадаад энергийн түвшинд аваачиж, Si -4 болгон сэргээнэ;

Цахиурын физик шинж чанар Цахиур нь метал биш бөгөөд талст, аморф байдалд байдаг. Кристал цахиур нь төмөр гялалзсан ган саарал бодис бөгөөд маш хатуу боловч эмзэг байдаг. Аморф цахиур нь хүрэн нунтаг юм. p \u003d 2.33 г / см 3; t pl. \u003d C; т боодол \u003d C;

Цахиурын болор бүтэц Цахиурын болор тор нь куб хэлбэртэй нүүрэн төвтэй алмазын төрөл юм. Гэхдээ Si - Si-ийн хоорондох холбоосын урт нь цахиурын хатуулаг нь алмазаас хамаагүй бага байдаг. Цахиур нь зөвхөн С-ээс дээш халахад л эмзэг байдаг.

Электрофизикийн шинж чанарууд Элементаль цахиур Элементаль цахиур бол ердийн хагас дамжуулагч юм. ердийн хагас дамжуулагч. Түүнд агуулагдах бичил хольц нь талст цахиурын электрофизик шинж чанарт ихээхэн нөлөөлдөг. Нүхний дамжуулалт бүхий цахиурын дан талстыг олж авахын тулд III бүлгийн бор, хөнгөн цагаан, галлий, индий элементийн нэмэлт бодисуудыг фосфор, хүнцэл, сурьма зэрэг V бүлгийн элементүүдийг электрон дамжуулалттай хамт цахиурд оруулдаг.


Цахиур чулуу цахиур чулуу, энэ бол цахиур чулуу юм, энэ бол утга агуулгагүй, маш тодорхой бус, маш удаан эдэлгээтэй чулуу, удаан эдэлгээтэй чулуу бөгөөд чулуун зэвсгийн эхэн үе - зууны зуун - цахиурын хэрэгслийн зууны суурийг тавьсан юм. цахиур чулуу. Хоёр шалтгаан бий: - цахиурын тархалт ба хүртээмж; - цахиурын тархалт ба хүртээмж; - чиплэх үед хурц зүсэх ирмэг үүсгэх чадвар; - чиплэх үед хурц зүсэх ирмэг үүсгэх чадвар;




Та үүнийг мэдсэн үү .. Цахиурыг цэвэр хэлбэрээр авах аргыг Николай Николаевич Бекетов боловсруулсан. ОХУ-д цахиур үйлдвэрлэдэг: Каменск - Уралский (Свердловск муж) Каменск - Уралский (Свердловск муж) Шелех (Иркутск муж). Шелех хот (Эрхүү муж).

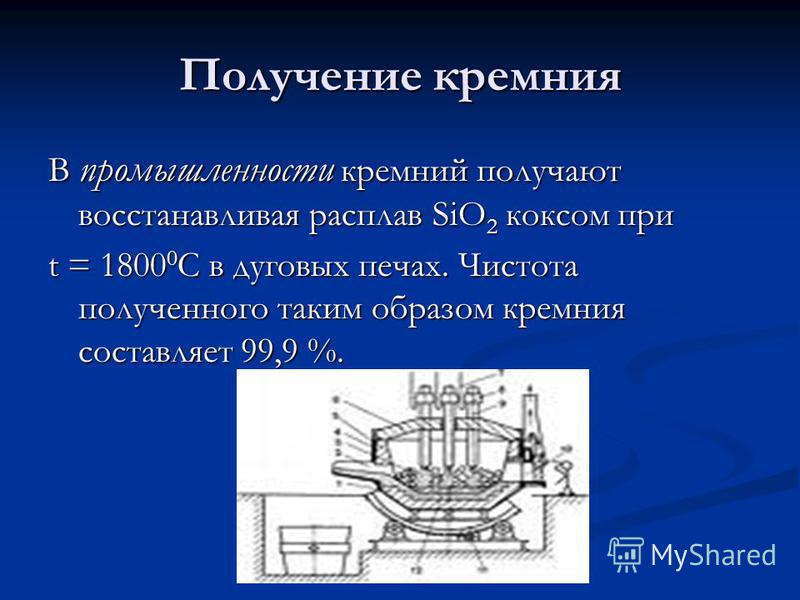
Цахиурын үйлдвэрлэл Аж үйлдвэрт SiO 2 хайлмалыг коксын хамт t \u003d C температурт нуман зууханд багасгах замаар гаргаж авдаг. Ийнхүү олж авсан цахиурын цэвэр байдал 99.9% байна.
Цахиурыг хүлээн авах Лабораторийн аргаар олж авах: SiO Mg 2MgO + Si SiO Mg 2MgO + Si


Цахиурын химийн шинж чанарууд 400 - С хүртэл халаахад цахиур хүчилтөрөгчтэй урвалд орж цахиурын давхар исэл үүсгэдэг: Si + O 2 SiO 2 Si + O 2 SiO 2



![]()
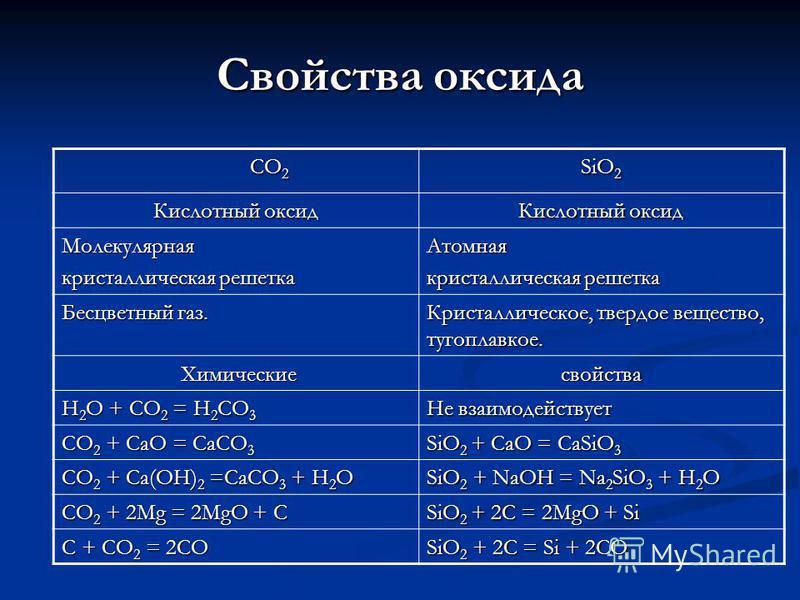
Оксидын шинж чанар CO 2 CO 2 SiO 2 Хүчиллэг исэл Молекулын болор тор Атомын өнгөгүй хий. Болор, хатуу, галд тэсвэртэй. Химийн химийн шинж чанар H 2 O + CO 2 \u003d H 2 CO 3 харилцан үйлчлэлцдэггүй CO 2 + CaO \u003d CaCO 3 SiO 2 + CaO \u003d CaSiO 3 CO 2 + Ca (OH) 2 \u003d CaCO 3 + H 2 O SiO 2 + NaOH \u003d Na 2 SiO 3 + H 2 O CO 2 + 2Mg \u003d 2MgO + C SiO 2 + 2C \u003d 2MgO + Si C + CO 2 \u003d 2CO SiO 2 + 2C \u003d Si + 2CO
Хүчлүүдийн шинж чанар H 2 CO 3 H 2 SiO 3 Хоёрдмол хүчилтөрөгч агуулсан, сул, эмзэг, учир нь дэгдэмхий. Хоёр суурьтай, хүчилтөрөгч агуулсан, сул, усанд уусдаггүй. Авах: CO 2 + H 2 O \u003d H 2 CO 3 олж авах: SiO 2 + H 2 O \u003d боломжгүй Тогтворгүй, хэврэг, зогсож эсвэл халах үед задардаг: H 2 CO 3 \u003d CO 2 + H 2 O Цэвэр хэлбэрээр тусгаарлах боломжгүй, оноос хойш халах үед задардаг: H 2 SiO 3 \u003d SiO 2 + H 2 O Zn + H 2 CO 3 \u003d ZnCO 3 + H 2 Хөнгөн хийн хувьсал __________

Цахиурын хүчлийн нүүрстөрөгчийн хүчил давс - карбонатууд; - гидрокарбонатууд; - силикат; - силикат; Карбонатууд нь давсны бүх шинж чанартай, хүчтэй электролитууд бөгөөд ионууд (усанд уусдаг) -т бүрэн диссоциаци хийдэг. Зөвхөн шүлтийн металлын давс нь уусдаг, бусад нь уусдаггүй эсвэл огт давс үүсгэдэггүй (Al +3, Cr +3, Ag +).
![]()



Биологийн үүрэг Хамгийн чухал цахиурын нэгдэл - SiO 2 нь ургамал, амьтны амьдралд шаардлагатай байдаг. Түүний ачаар зэгс, зэгс Түүний ачаар зэгс, зэгс, морины сүүл нь жад шиг бат бөх зогсож байдаг. морины сүүл нь жад шиг бат бөх зогсож байна. Хурц ирмэгтэй навч нь хутганы адил тайрч тайрсан хурц навчны навч шиг, тайрсан хээрийн хутга дээр сүрэл, хадаж авсан талбайн зүү шиг хатгаж, үр тарианы иш нь зүү шиг хатгаж, үр тарианы иш нь маш хүчтэй байдаг тул тэд тийм хүчтэй байхыг зөвшөөрдөггүй. Тариалан дахь эрдэнэ шишийн талбайг бороо орж хэвтэхийг бүү зөвшөөр, тариалангийн талбай дахь хур бороог салхинд хэвтэхийг бүү зөвшөөр


Цахиур бол хүний \u200b\u200bбиед байнга байдаг микроэлемент юм. Түүний хамгийн их хэмжээ нь тунгалгийн булчирхай, аортын холбогч эд, гуурсан хоолой, үс, арьсанд байдаг. Цахиур нь хучуур эдийн эсийг бий болгоход зайлшгүй шаардлагатай. Цахиур бол хүний \u200b\u200bбиед байнга байдаг микроэлемент юм. Түүний хамгийн их хэмжээ нь тунгалгийн булчирхай, аортын холбогч эд, гуурсан хоолой, үс, арьсанд байдаг. Цахиур нь хучуур эдийн эсийг бий болгоход зайлшгүй шаардлагатай. Цахиур нь ясны эрдэсжилтийн процесст чухал үүрэг гүйцэтгэдэг; Артерийн хананы уян хатан чанарыг хадгалах, дархлаанд сайнаар нөлөөлж, хүний \u200b\u200bбиеийн эд эсийн хөгшрөлтийг удаашруулах шаардлагатай. Цусан дахь цахиурын агууламж өдөрт дунджаар 8.25 мг байна. Нас ахих тусам түүний биеийн түвшин буурч, ахмад настнуудад цахиурын хэрэгцээ нэмэгддэг. Кальци, магни, манган, кали байгаа нь хүний \u200b\u200bбиед цахиурын шингээлтийг сайжруулдаг. Цахиур нь ясны эрдэсжилтийн процесст чухал үүрэг гүйцэтгэдэг; Артерийн хананы уян хатан чанарыг хадгалах, дархлаанд сайнаар нөлөөлж, хүний \u200b\u200bбиеийн эд эсийн хөгшрөлтийг удаашруулах шаардлагатай. Цусан дахь цахиурын агууламж өдөрт дунджаар 8.25 мг байна. Нас ахих тусам түүний биеийн түвшин буурч, ахмад настнуудад цахиурын хэрэгцээ нэмэгддэг. Кальци, магни, манган, кали нь биед цахиурын шингээлтийг сайжруулдаг.

Биологийн үүрэг Цахиур нь доод амьд организмууд болох диатом ба радиолариа найрлагад багтдаг бөгөөд тэдгээр нь цахиураас хамгийн шилдэг гоо сайхны араг ясыг үүсгэдэг амьд бодисын хамгийн нарийн бөөгнөрлийг үүсгэдэг. Цахиур нь доод амьд организмын нэг хэсэг юм диатом ба радиоларианууд - тэдний хамгийн гайхалтай гоо сайхны араг ясыг цахиураас бий болгодог амьд бодисын хамгийн нарийн бөөгнөрөл юм. Диатом радиоларианууд Өөрийгөө хянах 1. Цахиур нь үелэх системд ямар байр суурь эзэлдэг вэ: a) 2 үе, 4 гр. б) 3 үе, 3 гр. бүлэг. в) 3 үе, 4 гр. бүлэг) 2 үе, 4 гр. б) 3 үе, 3 гр. бүлэг. в) 3 үе, 4 гр. бүлэг. 2. Цахиурын болор тор: а) ион; б) атом; в) молекул; а) ион; б) атом; в) молекул; 3. Цахиур нь байгальд элбэг дэлбэг байдлаараа…. элемент: а) эхний; б) хоёр дахь; в) гуравдугаарт; а) эхний; б) хоёр дахь; в) гуравдугаарт; 4. Цахиур: а) металл, устөрөгч, галоген; a) металл, устөрөгч, галоген; б) металл, галоген, шүлтэнд амархан уусдаг; б) металл, галоген, шүлтэнд амархан уусдаг; в) исэл, хүчил, металл бус. в) исэл, хүчил, металл бус. 5. Цахиурын хүчлийн давс: а) силикид; б) гидросиликат; в) силикат; а) силикид; б) гидросиликат; в) силикат;

Цахиур.
Цахиур - Д.И.Менделеевын химийн элементүүдийн үечилсэн системийн 3-р үеийн IV бүлгийн үндсэн дэд бүлгийн элемент, атомын дугаар 14, атомын масс: 28.0855... Энэ нь ихэвчлэн +4 (валентын IV) исэлдэлтийн түвшинг харуулдаг ба маш ховор тохиолдолд +3, +2, +1 (тус тусдаа III, II, I валентт) агуулдаг. Менделеевийн үелэх системд цахиур нь IVA бүлэгт байрладаг (A-энэ нь үндсэн дэд бүлэг болохыг харуулж байна) (нүүрстөрөгчийн бүлэгт), гуравдугаар үед. Металл бус ... Тэмдгээр заана Си(лат. Цахиур). Чөлөөт хэлбэрээр - хүрэн нунтаг эсвэл цайвар саарал өнгийн метал гялалзсан авсаархан материал. Торны бүтэц: шоо, алмааз.
Үндсэн нөхцөл: + 14 Si 14 e 1s 2 2s 2 2p 6 3s 2 3p 2, p-элемент.
2. Физик шинж чанарууд.
Кристал цахиур нь ган гялалзсан хар саарал бодис юм. Цахиурын бүтэц нь алмазын бүтэцтэй төстэй байдаг. Кристал дотроо атом бүрийг тетраэдр хэлбэрээр дөрвөн өөр хүн хүрээлж, тэдгээртэй ковалент холбоогоор холбодог бөгөөд энэ нь алмаазан дахь нүүрстөрөгчийн атомуудын хооронд хамаагүй сул байдаг. Цахиурын болорт ердийн нөхцөлд ч гэсэн зарим ковалентын холбоо устдаг. Тиймээс дотор нь чөлөөт электронууд байдаг бөгөөд энэ нь бага цахилгаан дамжуулалт үүсгэдэг. Гэрэлтүүлж, халаахад эвдэрсэн бондын тоо нэмэгдэх бөгөөд энэ нь чөлөөт электронуудын тоо нэмэгдэж, цахилгаан дамжуулалт нэмэгдэнэ гэсэн үг юм. Цахиурын хагас дамжуулагч шинж чанарыг ингэж тайлбарлах хэрэгтэй.
Цахиур нь маш эмзэг бөгөөд нягтрал нь 2,33 г / см3 юм. Нүүрсний нэгэн адил галд тэсвэртэй бодисуудад хамаарна.
Цахиур нь гурван тогтвортой изотопоос бүрдэнэ: 2814Si (92.27%), 2914Si (4.68%), 3014Si (3.05%).
3. Байгальд байх.
Ихэнх тохиолдолд байгальд цахиур хэлбэртэй байдаг цахиур - цахиурын давхар исэл (IV) SiO2 (дэлхийн царцдасын массын 12 орчим хувь) дээр суурилсан нэгдлүүд. Цахиурын давхар ислээс үүсэх гол эрдэс ба чулуулаг нь элс (гол ба кварц), кварц ба кварцит, цахиур чулуу, хээрийн жонш юм. Байгалийн силикатууд нь нарийн төвөгтэй найрлага, бүтэцтэй байдаг. Байгалийн силикатуудын зарим нь:
ü хээрийн жонш К 2 О × Аl 2 O 3 × 6SiO 2,
ü асбест 3MgО × 2SiO 2 × 2H 2 O,
ü гялтгануур К 2 О × 3Аl 2 O 3 × 6SiO 2 × 2H 2 O,
ü каолинит 3Аl 2 O 3 × 2SiO 2 × 2H 2 O.
Байгальд цахиурын нэгдлүүдийн хамгийн түгээмэл хоёр дахь бүлэг нь силикатууд болон алюмосиликатууд.
Цэвэр цахиурыг уугуул мужаас олох тухай тусгаарлагдсан баримтуудыг тэмдэглэв.
4. Цахиур ба түүний нэгдлүүдийн химийн шинж чанарууд.
Химийн шинж чанарын хувьд цахиур нь нүүрстөрөгчийн нэгэн адил металл биш боловч метал бус байдал нь төдийлөн мэдрэгддэггүй, атомын радиустай тул Цахиурын атомууд нь гадаад энергийн түвшинд 4 электронтой тул цахиур нь -4 ба +4 хоёулангийнх нь исэлдэлтийн төлөвөөр тодорхойлогддог (цахиурын нэгдэл нь мэдэгдэж, исэлдэлтийн түвшин нь +2 байдаг).
Хэвийн нөхцөлд байгаа цахиур нь нэлээд идэвхгүй байдаг бөгөөд үүнийг болор торны бат бэх чанараар тайлбарлах хэрэгтэй. Тэр зөвхөн шууд харьцдаг фтор:
Хүчил (фторт HF ба азот HNO 3 холимогоос бусад)цахиур дээр бүү ажилла. Гэсэн хэдий ч энэ нь шүлтлэг металлын гидроксид уусч, силикат ба устөрөгч үүсгэдэг.
Цахиурын хоёр аллотроп өөрчлөлтөөс талст ба аморф - аморф цахиур нь химийн хувьд илүү идэвхтэй байдаг. Тэр хариу үйлдэл үзүүлдэг хүчилтөрөгч халах үед SiO 2 үүсгэдэг:
түүнчлэн бүгд галогенууджишээ нь:
![]()
Өндөр температур цахиур холбодог нүүрстөрөгчтэй, SiC карборунд үүсгэдэг:
Карборунд нь алмаазтай төстэй болор тортой бөгөөд цахиурын атом бүр нь дөрвөн нүүрстөрөгчийн атомаар хүрээлэгдсэн байдаг ба эсрэгээр нь ковалент холбоо нь алмаз шиг маш хүчтэй байдаг. Тиймээс хатуулгийн хувьд алмазтай ойролцоо байна. Нунтаглах чулуу ба нунтаглах дугуйг цахиурын карбидоор хийдэг.
Магнийн силицид. Үүсгэлт явагдаж байгаа идэвхтэй металлын урвалын үед силикид, цахиур нь исэлдүүлэгч бодисын үүрэг гүйцэтгэдэг.
Өндөр температурт цахиур нь олон металыг оксидоос нь бууруулдаг. (!!!)
Силан. Давсны хүчлийн силикидууд үйлчлэхэд хамгийн энгийн устөрөгчийн цахиурын нэгдэл силан SiH 4-ийг олж авна.
Силан бол тааламжгүй үнэртэй хорт хий бөгөөд агаарт аяндаа асдаг (!!!):
Цахиур (IV) исэл.Цахиурын (IV) оксидыг бас нэрлэдэг цахиур. Энэ бол хатуу галд тэсвэртэй бодис юм (хайлах температур 1700 ° C) , байгальд хоёр хэлбэрээр өргөн тархсан:
1) талст цахиур - кварцын эрдэс ба түүний сортуудын хэлбэрээр (чулуун болор, халцедон, агат, хаш чулуу, цахиур чулуу); кварц нь барилга байгууламж, силикат үйлдвэрт өргөн хэрэглэгддэг кварцын элсний суурийг бүрдүүлдэг;
2) аморф цахиур - SiO 2 × найрлагын ашигт малтмалын опал хэлбэрээр p H 2 O; аморф цахиурын шороон хэлбэрүүд нь диатомит, триполи (шилмүүст дэлхий); хиймэл аморф усгүй цахиурын жишээ бол натрийн метасиликатаас гаргаж авдаг цахиурын гель юм.
Цахиурын гель нь гадаргууг боловсруулсан тул чийгийг сайн шингээдэг .
1710 хэмд кварц хайлдаг... Хайлмал массыг хурдан хөргөхөд кварцын шил ... Энэ нь маш бага тэлэлтийн коэффициенттэй тул халуун кварцын шилийг усаар хурдан хөргөхөд хагардаггүй. Кварцын шилээр лабораторийн шилэн эдлэл, шинжлэх ухааны судалгааны багаж хэрэгсэл үйлдвэрлэхэд ашигладаг.
Цахиурын исэл (IV) SO 2-ийн хамгийн энгийн томъёо нь нүүрстөрөгчийн дутуу исэл (IV) CO 2-ийн томъёотой төстэй юм. Үүний зэрэгцээ тэдгээрийн физик шинж чанарууд эрс ялгаатай байна (SiO 2 нь хатуу, CO 2 нь хий юм). Энэ ялгааг болор торны бүтцээр тайлбарладаг. C0 2 нь молекулын торонд, SiO 2 нь атомын талстждаг. Хавтгай зураг дээрх SiO 2-ийн бүтцийг дараах байдлаар илэрхийлж болно.
Хатуу CO 2 дахь нүүрстөрөгчийн атомын зохицуулалтын тоо 2, SiO 2 дахь цахиурынх 4 байна. Цахиурын атом бүрийг 4 хүчилтөрөгчийн атомын тетраэдрээр хашина. Энэ тохиолдолд цахиурын атом нь төвд, хүчилтөрөгчийн атомууд нь тетраэдрийн оройд байрладаг. ... Цахиурын бүхэл хэсгийг болор гэж үзэж болох бөгөөд томъёо нь (SiO 2) n байна. Цахиурын исэл (IV) -ийн энэхүү бүтэц нь өндөр хатуулаг ба галд тэсвэртэй чанарыг тодорхойлдог .
Цахиурын исэл (IV) SiO 2 нь химийн шинж чанараараа хүчил исэлд багтдаг. Хатуу шүлт, үндсэн исэл ба карбонаттай уусахад цахиурын хүчлийн давс үүсдэг.
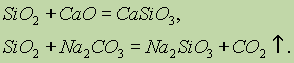
Зөвхөн гидрофторын хүчил нь цахиурын исэл (IV) -тэй харилцан үйлчилдэг.
Энэ урвалын дагуу шилийг сийлсэн болно .
Цахиур (IV) исэл нь усанд уусдаггүй химийн хувьд түүнтэй харьцдаггүй. (!!!) Тиймээс цахиурын хүчлийг кали эсвэл натрийн силикатын уусмал дээр хүчилээр үйлчлэх замаар шууд бус аргаар гаргаж авдаг.
Энэ тохиолдолд цахиурын хүчлийг (давс ба хүчлийн анхны уусмалын концентрацаас хамаарч) ус агуулсан желатин массын хэлбэрээр, мөн коллоид уусмал (sol) хэлбэрээр авах боломжтой.
Цахиурын хүчил. SiO 2 бол олон тооны цахиурын хүчлүүдийн ангидрид бөгөөд түүний найрлагыг ерөнхий томъёогоор илэрхийлж болно: xSiO 2 × yH 2 O, энд x ба y - бүхэл тоо:
1) x \u003d 1, y \u003d 1: SiO 2 × H 2 O, өөрөөр хэлбэл H 2 SiO 3 - метасилик хүчил;
2) x \u003d 1, y \u003d 2: SiO 2 × 2H 2 O, өөрөөр хэлбэл H 4 SiO 4 - ортофилик хүчил;
3) х \u003d 2, y \u003d 1: 2SiO 2 × H 2 O, өөрөөр хэлбэл H 2 Si 2 O 5 - ди-метасилик хүчил.
Цахиурын хүчил нь тетраэдрийн бүтцийн нэгжүүдээс бүтдэг (ийм нэгж бүрт цахиурын атом нь тетраэдрийн төвд, хүчилтөрөгчийн атомууд нь орой дээрээ байрладаг). Бүтцийн нэгжүүд нь гинжээр нэгдэж илүү тогтвортой полисилик хүчил үүсгэдэг.
Ийм нэгдлийн найрлагыг томъёогоор (H 2 SiO 3) n илэрхийлж болно. Гэхдээ ихэвчлэн цахиурын хүчил нь H 2 SiO 3 томъёогоор илэрхийлэгддэг. H 2 SiO 3 - хүчил нь маш сул, усанд бага зэрэг уусдаг. Халаахад нүүрстөрөгчийн хүчилтэй адил амархан задардаг.
Бүх цахиурын хүчил маш сул (нүүрстөрөгчөөс сул).
Силикатууд. Бүх цахиурын хүчлүүдийн давсыг нэрлэдэгсиликатуудГэсэн хэдий ч боловсролын ном зохиол дээр дүрмээр бол силикатууд нь метасиликат хүчил агуулдаг давсыг хэлдэг. Тэдний найрлага нь ихэвчлэн элементүүдийн оксидын нэгдэл хэлбэрээр томъёогоор илэрхийлэгддэг. Жишээлбэл, кальцийн силикат CaSiO 3-ийг дараахь байдлаар илэрхийлж болно: CaO x SiO 2.
R 2 O × nSiO 2 найрлагын силикатууд, энд R 2 O нь натри эсвэл калийн исэл юм , гэж нэрлэдэг уусдаг шил , а тэдгээрийн төвлөрсөн усан уусмалууд - шингэн шил . Хамгийн чухал нь натри уусдаг шил юм.
Агаар дахь нүүрстөрөгчийн дутуу исэл (IV) нь цахиурын хүчлийг давснаас зайлуулдаг тул агаарт зогсож байхдаа силикатын уусмал бүрхэг болно.
Цахиурын хүчил нь усанд бараг уусдаггүй - энэ шинж чанарыг SiO 3 2-ионы чанарын урвал болгон ашигладаг.
Силикатуудыг цахиурын оксидыг шүлт эсвэл карбонатаар хайлуулж олж авдаг.
5. SiO 3 2- ионы нээлт. (Би юу ч олж чадахгүй байна ...)
6. Хөрс үүсэх, ойн аж ахуйд цахиурын нэгдлүүдийн гүйцэтгэх үүрэг.
Магмын чулуулгийн найрлага нь нэлээд тогтвортой бөгөөд голчлон цахиур, хөнгөн цагаан, төмөр, шүлт, магни, кальцийн нэгдлүүдийг агуулдаг. SiO2-ийн агууламжийн дагуу магмын чулуулгийг хүчиллэг (\u003e 65%), дунд (52 - 65%), үндсэн (40-52%) ба хэт суурь (<40 %). Наиболее представительны две большие группы: кислые и основные породы. Как будет видно в дальнейшем, при характеристике многих типов почв именно этот фактор приуроченности почв к кислым или основным магматическим почвообразующим породам является решающим в отношении генезиса, эволюции и свойств почв.
Хүчиллэг магмын чулуулаг- боржин, пегматит, риолит, дацит болон бусад - ихэвчлэн кварц, хээрийн жонш, гялтгануурын тунгалаг талстуудтай цайвар, хүрэн өнгөтэй байдаг. Тэдгээрийн SiO 2-ийн агууламж өндөр (65% -иас дээш), мэдэгдэхүйц кали, натри агуулсан байдаг. Үүний зэрэгцээ төмөр бага байдаг бол кальци, магни нь ач холбогдолгүй юм. Жишээлбэл, хүчиллэг магмын чулуулаг дээрх хөрс нь өгөршлийн эхний үе шатанд анхны материалын сул, хайрган шинж чанараараа ялгаатай байдаг. Чийглэг нөхцөлд өгөршиж байх үед тэдгээр нь шүлтлэг дэлхийн элементүүдийг амархан алддаг бөгөөд үүний үр дүнд ийм өгөршсөн субстрат (чулуулгийн элюви) дээрх хөрс маш муу, үржил шимгүй байдаг.
Гол магмын чулуулаг -базальт, габбро гэх мэт дүрмээр бараан өнгөтэй (хар хүртэл) өнгөтэй байдаг. Эдгээр нь хүчиллэг чулуулагтай харьцуулахад бага SiO 2 агуулгаар тодорхойлогддог. Магмын үндсэн чулуулаг нь харьцангуй баялаг төмөр, манган, хром, кобальт, цайр, титан, никель, зэсийн нэгдлээр баялаг юм. Тэдний өгөршсөн бүтээгдэхүүн нь маш хурдан хугацаанд шавар шинж чанарыг олж авдаг бөгөөд шүлтлэг, төвийг сахисан урвалыг удаан хугацаанд хадгалж, ялзмаг, шаварлаг эрдэс бодисын агууламж ихэсдэг. Ийм чулуулаг дээрх хөрс илүү үржил шимтэй байдаг.
Хүчиллэг ба үндсэн чулуулагаас гадна шилжилтийн магмын чулуулаг(дунд) - диорит бүлгийн интрузив чулуулаг ба тэдгээрийн шүүдэсжилтийн аналоги - андезит. Үүний дагуу эдгээр чулуулаг дээрх хөрс нь хүчиллэг эсвэл үндсэн чулуулгаар хязгаарлагдах хөрстэй төстэй шинж чанарыг олж авдаг. Илүү бага нийтлэг байдаг хэт суурь чулуулаг:хамгийн бага SiO2 агууламжтай перидотит ба пикррит.
Метаморф чулуулаг -их хэмжээний талст ба тунамал чулуулгийн хоорондох шилжилт. Усанд умбах, өндөр даралт, температурын дор байх эртний тунамал чулуулаг метаморфжсон тул гнейс, серпентинит, гантиг, кварцит, занар үүсгэдэг. Гнейсс нь найрлагаараа боржин чулуутай ойр байдаг. Ийм чулуулаг дээр үүссэн хөрс нь хүчиллэг магмын чулуулаг дээрх хөрстэй ижил төстэй шинж чанартай байдаг.
Хлор.
1. Д.И.Менделеевийн хүснэгтэд хөнгөн цагааны байрлал. Атомын бүтэц, исэлдэлтийн төлөв байдал.
Хлор - VII бүлгийн үндсэн дэд бүлгийн элемент, 3-р үе, атомын дугаар 17. Үүнийг Cl (Latin Chlorum) тэмдгээр тэмдэглэв. Химийн идэвхитэй металл бус . Галоген бүлгийн хэсэг .
Ердийн нөхцөлд хлор агуулсан энгийн бодис - шаргал ногоон өнгөтэй хорт хий нь агаараас хүнд, хурц үнэртэй байдаг . Хлорын молекул нь диатом юм (томъёо Cl 2).
Газрын төлөв: +17 Cl 17e1s 2 2s 2 2p 6 3s 2 3p 5, p-элемент. Урлаг.: -1 +1 +3 +5 +7.
Электрон бүрхүүлийн бүтэц.
Хлорын атомын валентын түвшин агуулдаг 1 хосгүй электрон : 1s 2 2s 2 2p 6 3s 2 3p 5, тиймээс хлорын атомын хувьд 1-ийн утга маш тогтвортой байна. Хлорын атомд эзэнгүй d-sublevel тойрог зам байдаг тул хлорын атом нь бусад исэлдэлтийн түвшинг харуулж чаддаг. Атомын өдөөгдсөн төлөвийг бүрдүүлэх схем:
Хлорын нэгдлүүд нь 4 ба 6-ийн валентыг албан ёсоор харуулдаг жишээлбэл ClO 2 ба Cl 2 O 6 гэсэн хлорын нэгдлүүдийг бас мэддэг. Гэсэн хэдий ч эдгээр нэгдлүүд нь радикалууд бөгөөд тэдгээр нь нэг хосгүй электронтой гэсэн үг юм.
2. Физик шинж чанарууд.
Ердийн нөхцөлд хлор бол шар-ногоон хий бөгөөд амьсгал боогдуулдаг. Түүний зарим физик шинж чанарыг дор үзүүлэв.
Нягтрал: 3.214 г / л, шингэн - -35 0 С - 1.557, телевизор. -105 0 С - 1.9 г / см 3.
Хайлах цэг: 172.2 К
Буцалгах цэг: 238.6 K
Хайлмал дулаан: 6.41 кДж / моль
Ууршилтын дулаан: 20.41 кДж / моль.
Хлорын хий харьцангуй амархан шингэрдэг. 0.8 МПа (8 агаар мандал) даралтаас эхлээд хлор нь өрөөний температурт шингэн байх болно. Хлор нь мөн хэвийн атмосферийн даралттай үед -34 ° C хүртэл хөргөхөд шингэн болдог. Шингэн хлор нь маш өндөр идэмхий нөлөө бүхий шар-ногоон шингэн (молекулын өндөр концентрацаас болдог). Даралтыг нэмэгдүүлснээр 7.6 МПа критик даралттай үед шингэн хлорыг +144 ° C (чухал температур) температурт байлгах боломжтой. Цахилгаан дамжуулалтын хувьд шингэн хлор нь хамгийн хүчтэй тусгаарлагчдын тоонд ордог: нэрмэл уснаас бараг тэрбум дахин муу, мөнгөнөөс 10 22 дахин муу дамжуулдаг. Хлор дахь дууны хурд нь агаараас нэгээс хагас дахин бага байдаг.
3. Байгальд байх.
Байгаль дээр хлорын 35 Cl ба 37 Cl гэсэн хоёр изотоп байдаг. Хлор бол дэлхийн царцдас дахь хамгийн их тархсан галоген юм. ... Хлор нь маш идэвхтэй байдаг - энэ нь үелэх системийн бараг бүх элементүүдтэй шууд холбогддог. Тиймээс байгальд энэ нь зөвхөн ашигт малтмалын найрлага дахь нэгдэл хэлбэрээр олддог.
ü галит NaCl,
ü sylvina KCl,
ü sylvinite KCl NaCl,
ü бишофит MgCl 2 6H 2 O,
ü карналлит KCl MgCl 2 6H 2 O,
ü kainita KCl MgSO 4 3H 2 O.
Хлорын хамгийн их нөөцийг давс, ус, далай, далай тэнгисийн найрлагад агуулдаг (далайн усны агууламж 19 г / л). Хлор нь дэлхийн царцдасын нийт атомын 0.024% -ийг эзэлдэг; кларк дугаар (дэлхийн царцдас, гидросфер, дэлхий, сансрын биетүүд, геохимийн эсвэл космохимийн систем гэх мэт химийн элементүүдийн дундаж агууламжийг энэ системийн нийт масстай харьцуулсан тоог илэрхийлсэн тоо.% эсвэл г / кг-аар илэрхийлнэ.) хлор - 0.017%. Хүний биед жингийн 0.25% хлорын ион байдаг. Хүн, амьтанд хлор нь эс хоорондын шингэнд (цус орно) голчлон агуулагддаг бөгөөд осмосын процессыг зохицуулах, түүнчлэн мэдрэлийн эсийн ажилтай холбоотой үйл явцад чухал үүрэг гүйцэтгэдэг.
4. Хлор ба түүний нэгдлүүдийн химийн шинж чанарууд. Хлорын үйлдвэрлэл.
Цахиурын атомын бүтэц. Си. +14. Догдолсон байдал. E. 3d. 3х. 3с. E. 3d. 3х. 3с. 1s 2s 2p 3s 3p. 2e 8e 4e. 2. 2. 6. 2. 2.
"Цахиур" танилцуулгын 3-р зураг "Цахиур" сэдэвт химийн хичээлүүдэдХэмжээ: 960 x 720 пиксел, формат: jpg. Химийн хичээлийн зургийг үнэгүй татаж авахын тулд зураг дээр хулганы баруун товчийг дараад "Зургийг хадгалах хэлбэрээр ..." дээр дарна уу. Хичээл дээрх зургуудыг харуулахын тулд та "Silicon.ppt" танилцуулгыг zip архив дахь бүх зургуудтай хамт үнэгүй татаж авах боломжтой. Архивын хэмжээ 562 КБ байна.
Танилцуулгыг татаж авахЦахиур
"Цахиур ба түүний нэгдлүүд" - Атомын бүтэц, шинж чанар. Хагас дамжуулагч. хайлмал (Si) \u003d 1415 ° C, хайлмал (алмаз) \u003d 3730 ° C Цахиур авч байна. Цахиурын нээлт. Энэ нь ургамал, амьтдын нэг хэсэг юм. Цахиурын физик шинж чанарууд. Энэ нь тоосго нь керамик, плита, эртний Грекийн амфорагийн хэлтэрхий бас шаазан гэсэн үг юм. Хичээлийн зорилго: Цахиурын химийн шинж чанар.
"Цахиурын нэгдлүүд" - Цахиур ба түүний нэгдлүүд. SiO2-ийн химийн шинж чанарууд. Силан. Цахиурын хүчил авах. Цахиурын шинж чанар. Цахиурын исэл. Байгалийн силикатууд. Исэлдэлтийн байдал. Rhinestone. Топаз. Лабораторид цахиур олж авах. Байгальд байх. Талст тор. Цахиурын нээлт. Номин талст. Цахиур авч байна.
"Цахиурын изотопууд" - Цахиурын изотопуудыг ялгах. Поликристал цахиур олж авах. Моноизотопик цахиур ашиглах хэтийн төлөв. Кварцын тигелээс дан болор ургахад изотопын шингэрүүлэлт. Монокристаллын үрийн үйлдвэрлэл. Раман туузны хамгийн их байрлалын атомын массаас хамаарах байдал.
"Цахиурын хичээл" - Амьд ба амьгүй байгальд химийн элементүүдийн аль нь хамгийн чухал вэ? Нүүрстөрөгч ба цахиурын исэл. Бодис тунгалаг байна. Металл бус ба металлын шинж чанарын илрэлийн талаар. Тусгалыг нэгтгэн дүгнэж байна. Эцсийн шалгалт. Нүүрстөрөгч ба цахиурын исэл, гидроксид? Нэгтгэх байдал: а) шингэн, б) хий, в) хатуу.
"Цахиур" - Цахиур бол энгийн бодис юм. Физик шинж чанарууд. Цахиур (IV) исэл. Силицид. Амьд организмын ач холбогдол. Металлын харилцан үйлчлэл. Металл бус харилцан үйлчлэл. Цахиурын карбид. Байгалийн цахиур. Цахиур. Силикат үйлдвэрлэлийн бүтээгдэхүүн. Байгалийн цахиурын нэгдлүүдийн нэг бол силикат юм.
"Нүүрстөрөгч ба цахиур" - Цахиур (IV) исэл. Үндсэн дэд бүлгийн IV бүлгийн элементүүд. Хоруу чанар. 7. Нүүрстөрөгчийн тухай сонирхолтой баримтууд. Силикатууд. Хүрэхэд хальтиргаа. Алмаз бол байгалийн хамгийн хатуу бодис юм. Химийн шинж чанар. Агаар мандал дахь нүүрстөрөгчийн 99% -иас илүү нь нүүрстөрөгчийн давхар исэл хэлбэрээр агуулагддаг. Карбид. 6. Програм. Хамгийн зөөлөн хатуу бодисын нэг.
Нийт 6 илтгэл байна
